| 杨梅素的研究进展 |
| 发布时间:2013-07-30 信息来源:admin 发布人:admin 点击次数:2953 |
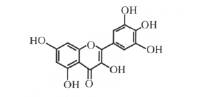
林国钡1,谢 燕1,李国文2 [摘要] 杨梅素是一种广泛存在于杨梅等多种天然植物中的黄酮醇类化合物,具有抗炎镇痛、抗肿瘤、降血糖、保肝等多种药理活性,显示出丰富的资源优势和巨大的潜在利用价值。本文从杨梅素的药理作用、体内过程、分析方法、制剂现状等方面进行综述,以期对今后杨梅素的研究开发有所裨益。 [关键词] 杨梅素; 黄酮醇类; 药理作用; 分析,光谱法,色谱法; 剂型 [中图分类号] R931; R944; R961 [文献标识码] A [文章编号] 1674-0440( 2012) 06-0483-05 杨梅素( 3,5,7,3,4,5,-六羟基黄酮,myrice-tin) 又名杨梅树皮素,广泛存在于多种天然植物中。现代药理学研究表明,杨梅素具有广泛的药理活性,同时具有抗炎、镇痛、抗肿瘤、降血糖和保肝等多种功效,尤其在防治心血管疾病方面作用明显。鉴于其抗氧化功能及降低胆固醇等作用,欧洲特别是一些地中海国家已有将杨梅素作为保健食品上市,但 还未有相关药品上市,因此具有较大的开发和应用潜力。除药理活性外,杨梅素在其他领域的研究亦有许多有益的探索与成果,如杨梅素的提取分离纯化工艺已相当成熟,高效液相色谱法、质谱法、循环伏安法及多种方法的联用也已成功应用于杨梅素的分析中; 杨梅素的滴丸、分散片、环糊精包合物和纳米脂质体等制剂研究也取得一定进展。本文通过查阅近年文献,对杨梅素的理化性质、提取纯化、药理作用、体内过程、分析方法、制剂现状等方面研究进行综述,以期为杨梅素在医药领域进一步的研究应用提供参考。 1 理化性质 杨梅素是一种多羟基黄酮醇类化合物( 图 1) ,为黄色针状结晶,分子式 C15H10O8,相对分子质量318,熔点 324. 0 ~ 325. 5 ℃ ,紫外光谱在 376. 5 nm ( 带Ⅰ) 、254 nm( 带Ⅱ) 处有最大吸收,红外光谱示有羟基( 3575,3380,3255 cm- 1) 、共轭羰基( 1646cm- 1) 、双键以及芳环碳骨架振动 ( 1662,1550, 1505,1454 cm- 1) 吸收[1]。该化合物溶于甲醇、乙醇和丙酮,微溶于乙酸乙酯,不溶于水、石油醚( 60 ~90 ℃ ) 、氯仿、甲苯和正己烷,且抗光解能力差,在酸性条件下较稳定,而偏中性及碱性环境中易被破坏。
图 1 杨梅素的化学结构 2 提取纯化 杨梅 素是 杨 梅 科 植 物 杨 梅〔Myrica rubra( Loar. ) zucc〕的树皮及叶的主要化学成分,也存在于洋葱、浆果和茶等天然植物中[2-3],是红酒中的主要黄酮醇成分之一。因其来源广泛,在药物的研究与应用中具有资源优势。近年来,对杨梅素的提取分离及纯化研究已取得一定进展。Du 等[4]采用离子液体微波辅助萃取技术从杨梅叶中提取分离出杨梅素,与传统的加热或酸水解相比,该法能大大缩减水解时间并提高产物得率。Tian 等[5]采用多相萃取技术,以氨基酸离子液体为模板剂合成的 MCM-41 介孔分子筛作为吸附剂,从柏科植物日本扁柏中提取分离得到杨梅素,提取率可达 0. 018%,该法偏差低、所需溶剂量少、分离的选择性与稳定性高。杨国勋等[6]对红花锦鸡儿地上部分的乙酸乙酯提取部位再进行了反复硅胶柱 色谱 分 离 后 得 到 杨 梅 素,但 提 取 率 只 有0. 000075% 。除此之外,野牡丹科植物 Mouriri pusaGardn 及五桠果科植物 Davilla elliptica St. Hill 的叶,葡萄科植物葡萄、石榴科植物石榴及紫金牛科植物着色紫金牛的果实,十字花科植物萝卜的叶及茎也都可以提取分离得到杨梅素[7-12]。 3 药理作用 3. 1 抗心血管疾病 杨梅素在抗动脉粥样硬化、缺血再灌注损伤、心肌梗死和高血压病等方面的研究已取得较大进展。体外实验发现,杨梅素等黄酮醇化合物可剂量依赖性地抑制低密度脂蛋白的糖化,同时减少糖化低密度脂蛋白电泳迁移,故可降低糖尿病患者动脉硬化的风险[13]。对心肌梗死模型小鼠连续给予杨梅素100 和 300 mg / kg 21 d 后,均可增加对超氧化自由基的清除,逆转由异丙肾上腺素引起的心肌梗死大鼠心肌细胞膜损伤及淋巴细胞浸润[9],还可减轻大鼠心肌缺血再灌注期间心肌细胞的坏死程度,减少肌酸磷酸激酶的释放,显著改善缺血心脏功能及左心室收缩压、舒张末期压[14]。Borde 等[15]研究发现,杨梅素 100 和 300 mg/kg 给药 4 周后,均可降低对醋酸去氧皮质酮诱导的高血压病模型大鼠的收缩压、血管反应性变化及心率,这与杨梅素抑制体内的5-羟色胺及血管紧张素 Ⅱ 受体有关。临床研究发现,日常摄入杨梅素、槲皮素和山奈酚等 3 种黄酮类成分,可防止体内低密度脂蛋白的氧化,改善血管功能[16]。可见,杨梅素能有效降低心血管疾病的风险,在抗心血管疾病方面极具应用价值。 3. 2 抗肿瘤杨梅素可通过抑制肿瘤细胞的生长与增殖、抑制肿瘤细胞转移、促进肿瘤细胞凋亡等途径,发挥抗肿瘤作用。研究表明,杨梅素 10 μmol/L 能明显抑制 JP6 P+小鼠表皮细胞的恶性转化及增殖,其机制是阻断 MEK/ERK/AP-1 信号路径[2]; 杨梅素还可抑制蛋氨酸及 Akt 活性,影响成髓细胞瘤肌动蛋白细胞骨架重组,遏制成髓细胞瘤细胞在转移过程中由肝细胞生长因子导致的形态学变化,从而抑制其转移,其 IC50值为 6 μmol/L[17]; Phillips 等[18]研究发现,杨梅素 25 ~ 200 μmol/L 呈剂量依赖性地抑制Akt 磷酸化,阻碍 PI-3 激酶信号途径,从而抑制转移性胰腺癌细胞的生长并促进其凋亡,而只有当剂量达到 200 μmol/L 时才对正常胰腺细胞生长产生显著影响; Siegelin 等[19]也证实,杨梅素 100 ~ 150μmol/L 能够有效增强肿瘤坏死因子( TNF) 相关抗肿瘤药物介导的恶性胶质瘤细胞的凋亡。 3. 3 抗细菌和病毒感染 杨梅素的抗菌作用与其结构密切相关,尤其是与其结构中的多酚羟基直接关联。Naz 等[10]的体外实验结果显示,杨梅素对棒杆菌属、葡萄球菌属、链球菌属和枯草芽孢杆菌等均有不同程度的抑菌作用,其作用机制是通过结构中的酚羟基与细菌中蛋白的非特异性反应,导致蛋白失活并丧失功能。Chen 等[20]运用荧光猝灭法证实,杨梅素通过其芳香环上的羟基与肺炎克雷伯菌中 DnaB 解旋酶的dNTP 结合,从而降低细菌的存活率,而其与不同dNTP 的结合力表现为 dCTP≈dGTP > dTTP > dATP。Lyu 等[21]采用空斑减数实验发现,杨梅素 5、10 和50 μmol / L 对Ⅰ、Ⅱ型单纯疱疹病毒的空斑抑制率可达到 50% ~80%。 3. 4 其他杨梅素还具有抗炎、抗过敏[22-24]、抗氧化[25-26]等药理活性。杨梅素 30 μmol/L 能通过抑制肥大细胞系 RBL-2H3 细胞中 IgM 或组胺释放,抑制肥大细胞内钙的升高及核因子-κB 的活化,减少 TNF-α、白细胞介素-6 生成,从而治疗过敏性炎症[22]。Kang等[26]用过氧化氢 1 mmol/L 对 V79-4 细胞进行氧化应激损伤,再以杨梅素 30 μmol/L 对其进行处理后发现,细胞中 Bcl-2 水平增加,凋亡相关蛋白 Bax、半胱天冬酶-3、9 的表达减少,同时细胞色素 c 从线粒体释放至胞浆过程被抑制,从而防止氧化应激诱导的细胞凋亡。研究人员分别以大鼠为模型,证实杨梅素在保护神经[27-28]、降血糖[29]、抗肝损伤[30]和防治骨质疏松[31]等方面也具有一定作用。这些不同的生物活性与黄酮类成分强大的抗氧化活性密切相关。此外,对杨梅素进行适当化学结构修饰,可使其产生新的作用。如 Dimas 等[32]合成杨梅素的 3,5-双乙酰衍生物,发现其对人白血病细胞株表现出较强的细胞毒性并抑制其生长,而杨梅素则无此作用。可见对杨梅素的结构改造具有重大意义,可进一步扩大其应用范围。 4 体内过程 Zhang 等[33]进行了大鼠灌胃给予杨梅素藤茶提取物 1564. 8 mg/kg 后的药代动力学研究,发现杨梅素的血药峰浓度( cmax) 为 0. 47 mg/L,达峰时间为14. 7 min,药时曲线下面积( AUC0 ~ ∞) 为301. 9 mg·min / L。表明藤茶提取物中杨梅素口服吸收速度较快,但其口服吸收程度如何还有待进一步探索。关于杨梅素与其他药物相互作用的研究,Choi 等[34]将杨梅素与多柔比星合用后发现,杨梅素能显著增加多柔比星 AUC 值及 cmax,同时提高了多柔比星的绝对生物利用度,但是对多柔比星静脉注射的药代动力学没有显著影响。杨梅素也可增加他莫昔芬及卡维地洛的口服生物利用度[35-36]。可能由于多柔比星、他莫昔芬和卡维地洛为 P-糖蛋白的底物,杨梅素通过抑制 P-糖蛋白的外排作用,从而增强多柔比星等药物的吸收,因此推测杨梅素可能为 P-糖蛋白的抑制剂。此外,杨梅素还可抑制小肠、肝中的细胞色素 P450 3A 酶而降低首过效应,这可能是增加多柔比星等药物口服吸收的另一原因。关于杨梅素在体内的吸收、分布、代谢、排泄过程尚无系统全面的研究。 5 分析方法 杨梅素的主要分析方法有光谱法与质谱法,其中,高效液相色谱法( HPLC) 是应用最广泛的检测方法之一。游璐茜等[37]采用反相高效液相色谱法 ( RP-HPLC) 分析檵木中杨梅素、槲皮素和山奈酚3 种成分,所建立的方法准确度和精密度良好,可用于檵木的质量控制。Patel 等[38]采用高效薄层色谱法建立了毛杨梅树皮中杨梅素的定量分析方法,该方法操作简便易行,但不如 HPLC 法灵敏、准确。近年来,逐渐出现将多种手段同时用于杨梅素的定量分析,以达到提高检测灵敏度、缩短分析时间的效果,如采用固相微萃取-HPLC-紫外新型检测系统对植物中的杨梅素进行提取和检测,其检测限可达48. 3 ng / L,此方法已成功应用于西红柿、洋葱、葡萄及葡萄酒中杨梅素的含量测定[39]; 采用超高压液相-四级杆飞行时间质谱技术在 12 min 内分析黄葵胶囊中杨梅素等 12 种成分,此方法大大缩短检测时间,适合分析成分复杂的样品[40]; 采用循环伏安法和原位薄层长光程紫外-可见光谱电化学法对杨梅素的氧化过程进行测试,有效揭示了杨梅素的抗氧化作用与分子结构的关系[41]。相信随着分析技术的不断提高,将有更多新仪器、新方法用于杨梅素定性、定量研究中,从而有力推动杨梅素的开发应用进程。 6 制剂研究 药物最终都以制剂的形式应用于临床,虽然目前还未有杨梅素制剂产品上市,但已有杨梅素制剂研究的相关报道。为提高杨梅素制剂的体外溶出度,覃洁萍等[42-43]采用正交设计法研制了杨梅素分散片,与杨梅素普通片相比,分散片溶出度高,且溶出速度快; 将杨梅素分散片与滴丸的抗血栓作用进行比较后发现,杨梅素分散片的抗小鼠凝血及抗二磷酸腺苷诱导的小鼠急性肺栓塞的效果均强于滴丸剂。Landi-Librandi 等[44]采用乙醇注入法将杨梅素制成脂质体,以期改善其膜渗透性并提高疗效,结果显示杨梅素纳米脂质体的抗氧化活性明显高于杨梅素。此外,为了提高杨梅素的稳定性,王晓云等[45]制备了杨梅素的 HP-β-CD 包合物,结果显示,经包合后,杨梅素的抗光解能力、抗氧化能力均有所增强。张颖慧等[46]采用加水滴定法制备了杨梅素O / W型微乳,所得杨梅素微乳粒径大小均一,且杨梅素可在 24 h 内缓慢释放。可见,微乳制剂不仅能够增加杨梅素在水中的溶解度,而且还能增加杨梅素的释药量,延长释药时间,从而起到缓释的作用。关于杨梅素给药系统目前多停留在一些口服传统剂型及制剂中间体的研究,其他给药途径和给药形式尚未涉及,因此,杨梅素制剂的相关研究具有广阔的发展空间。 7 结语 杨梅素作为一种天然的活性成分,具有广泛的药理作用,且作用途径多样,表现出一定的双向调节作用及剂量依赖性。目前,杨梅素的理化性质、药理作用及机制已基本被阐明,为其给药系统、体内过程和药物相互作用等方面的研究提供了依据。杨梅素的水溶性和脂溶性均较差,导致其口服吸收不好,不能充分发挥药效,若能运用现代制剂技术改善其溶解性,提高口服生物利用度,将大大提升该药物的实用价值。如可采用纳米技术减小药物粒径,改善药物的溶解性和渗透性,从而增加其体内吸收; 同时纳米制剂还表现出很强的靶向性,使药物浓集于靶器官组织中,增强疗效。此外,杨梅素的稳定性较差,在体内易转化降解而影响疗效,因此可考虑将杨梅素与合适载体结合制成前体药物,使其在体内适时释放出杨梅素,提高生物利用度。然而杨梅素的口服吸收特性与安全性还不明确,限制了其作为药物的开发,如能运用恰当吸收模型对杨梅素的吸收特性及机制进行阐释,并采用适宜方法评价杨梅素的安全性,设计有效的给药系统,必定能推动该药物的开发进程。 [1] 覃洁萍,许学建,董明姣. 广西藤茶中黄酮类成份的提取工艺研究[J]. 中国现代应用药学杂志,2000,17( 3) : 196-197. [2] Lee KW,Kang NJ,Rogozin EA,et al. Myricetin is a novel nat-ural inhibitor of neoplastic cell transformation and MEK1[J].Carcinogenesis,2007,28( 9) : 1918-1927. [3] Kim W,Yang HJ,Youn H,et al. Myricetin inhibits akt survivalsignaling and induces bad-mediated apoptosis in a low dose ultra-violet ( UV) -B-irradiated HaCaT human immortalized keratino-cytes[J]. J Radiat Res,2010,51( 3) : 285-296. [4] Du FY,Xiao XH,Li GK. Ionic liquid aqueous solvent-basedmicrowave-assisted hydrolysis for the extraction and HPLC deter-mination of myricetin and quercetin from Myrica rubra leaves[J].Biomed Chromatogr,2011,25( 4) : 472-478. [5] Tian M,Bi W,Row KH. Simultaneous extraction and purifica-tion of myricetin from Chamaecyparis obtusa by multi-phase ex-traction with ionic liquid-modified mesoporous MCM-41[J]. JChem Technol Biotechnol,2012,82( 2) : 165-169. [6] 杨国勋,亓建斌,程科军,等.红花锦鸡儿地上部分抗 HIV化学成分的研究[J]. 药学学报,2007,42( 2) : 179-182. [7] Andreo MA,Ballesteros KVR,Hiruma-Lima CA,et al. Effect of Mouriri pusa extracts on experimentally induced gastric lesions in rodents: role of endogenous sulfhydryls compounds and nitric ox-ide in gastroprotection[J]. J Ethnopharmacol,2006,107 ( 3) : 431-441. [8] Rodrigues CM,Rinaldo D,Sannomiya M,et al. High-perform-ance liquid chromatographic separation and identification of poly-phenolic compounds from the infusion of Davilla elliptica St. Hill[J]. Phytochem Anal,2008,19( 1) : 17-24. [9] Tiwari R,Mohan M,Kasture S,et al. Cardioprotective potential of myricetin in isoproterenol-induced myocardial infarction in Wistar rats[J]. Phytother Res,2009,23( 10) : 1361-1366. [10] Naz S,Siddiqi R,Ahmad S,et al. Antibacterial activity directed isolation of compounds from Punica granatum[J]. J Food Sci, 2007,72( 9) : M341-M345. [11] Sumino M,Sekine T,Ruangrungsi N,et al. Ardisiphenols and other antioxidant principles from the fruits of Ardisia colorata[J].Chem Pharm Bull ( Tokyo) ,2002,50( 11) : 1484-1487. [12] Beevi SS,Narasu ML,Gowda BB. Polyphenolics profile,antiox-idant and radical scavenging activity of leaves and stem of Rapha-nus sativus L[J]. Plant Foods Hum Nutr,2010,65( 1) : 8-17. [13] Ghaffari MA,Mojab S. Influence of flavonols as in vitro on low density lipoprotein glycation[J]. Iran Biomed J,2007,11( 3) : 185-191. [14] Scarabelli TM,Mariotto S,Abdel-Azeim S,et al. Targeting STAT1 by myricetin and delphinidin provides efficient protection of the heart from ischemia / reperfusion-induced injury[J]. FEBS Lett, 2009,583( 3) : 531-541. [15] Borde P,Mohan M,Kasture S. Effect of myricetin on deoxycorti-costerone acetate ( DOCA) -salt-hypertensive rats[J]. Nat ProdRes,2011,25( 16) : 1549-1559. [16] Geleijnse JM,Launer LJ,Van der Kuip DA,et al. Inverse asso-ciation of tea and flavonoid intakes with incident myocardial infarction: the Rotterdam Study[J]. Am J Clin Nutr,2002,75 ( 5) : 880-886. [17] Labbé D,Provencal M,Lamy S,et al. The flavonols quercetin, kaempferol, and myricetin inhibit hepatocyte growth factor-induced medulloblastoma cell migration[J]. J Nutr,2009,139 ( 4) : 646-652. [18] Phillips PA,Sangwan V,Borja-Cacho D,et al. Myricetin induces pancreatic cancer cell death via the induction of apoptosis and in-hibition of the phosphatidylinositol 3-kinase ( PI3K ) signaling pathway[J]. Cancer Lett,2011,308( 2) : 181-188. [19] Siegelin MD,Gaiser T,Habel A,et al. Myricetin sensitizes ma-lignant glioma cells to TRAIL-mediated apoptosis by down-regula-tion of the short isoform of FLIP and bcl-2[J]. Cancer Lett, 2009,283( 2) : 230-238. [20] Chen CC,Huang CY. Inhibition of Klebsiella pneumoniae DnaBhelicase by the flavonol galangin[J]. Protein J,2011,30( 1) : 59-65. [21] Lyu SY,Rhim JY,Park WB. Antiherpetic activities of flavonoids against herpes simplex virus type 1 ( HSV-1) and type 2 ( HSV-2) in vitro[J]. Arch Pharm Res,2005,28( 11) : 1293-1301. [22] Park HH,Lee S,Son HY,et al. Flavonoids inhibit histamine release and expression of proinflammatory cytokines in mast cells[J]. Arch Pharm Res,2008,31( 10) : 1303-1311. [23] Geraets L,Moonen HJ,Brauers K,et al. Dietary flavones and flavonoles are inhibitors of poly ( ADP-ribose ) polymerase-1 in pulmonary epithelial cells[J]. J Nutr,2007,137 ( 10 ) : 2190-2195. [24] Medeiros KC,Figueiredo CA,Figueredo TB,et al. Anti-allergic effect of bee pollen phenolic extract and myricetin in ovalbumin-sensitized mice[J]. J Ehnopharmacol,2008,119( 1) : 41-46. [25] Sim GS,Lee BC,Cho HS,et al. Structure activity relationship of antioxidative property of flavonoids and inhibitory effect on ma-trix metalloproteinase activity in UVA-irradiated human dermal fi-broblast[J]. Arch Pharm Res,2007,30( 3) : 290-298. [26] Kang KA,Wang ZH,Zhang R,et al. Myricetin protects cells against oxidative stress-induced apoptosis via regulation of PI3K /Akt and MAPK signaling pathways[J]. Int J Mol Sci,2010,11 ( 11) : 4348-4360. [27] Ma ZG,Wang J,Jiang H,et al. Myricetin reduces 6-hydroxydo-pamine-induced dopamine neuron degeneration in rats[J]. Neu-roreport,2007,18( 11) : 1181-1185. [28] Shimmyo Y,Kihara T,Akaike A,et al. Multifunction of myrice-tin on Ab: neuroprotection via a conformational change of Ab and reduction of Aβ via the interference of secretases[J]. J Neurosci Res,2008,86( 2) : 368-377. [29] Liu IM,Tzeng TF,Liou SS,et al. Improvement of insulin sensi-tivity in obese Zucker rats by myricetin extracted from Abelmos-chus moschatus[J]. Planta Med,2007,73( 10) : 1054-1060. [30] Maheshwari DT,Yogendra Kumar MS,Verma SK,et al. Antiox-idant and hepatoprotective activities of phenolic rich fraction of Seabuckthorn ( Hippophae rhamnoides L. ) leaves[J]. Food Chem Toxicol,2011,49( 9) : 2422-2428. [31] Yamaguchi M,Hamamoto R,Uchiyama S,et al. Effects of fla-vonoid on calcium content in femoral tissue culture and parathy-roid hormone-stimulated osteoclastogenesis in bone marrow culture in vitro[J]. Mol Cell Biochem,2007,303( 1-2) : 83-88. [32] Dimas K,Demetzos C,Angelopoulou D,et al. Biological activity of myricetin and its derivatives against human leukemic cell lines in vitro[J]. Pharmacol Res,2000,42( 5) : 475-478. [33] Zhang YS,Zhang QY,Li LY,et al. Simultaneous determination and pharmacokinetic studies of dihydromyricetin and myricetin in rat plasma by HPLC-DAD after oral administration of Ampelopsis grossedentata decoction[J]. J Chromatogr B,2007,860( 1) : 4-9. [34] Choi SJ,Shin SC,Choi JK. Effects of myricetin on the bioavail-ability of doxorubicin for oral drug delivery in rats: possible role of CYP3A4 and P-glycoprotein inhibition by myricetin[J]. Arch Pharm Res,2011,34( 2) : 309-315. [35] Li C,Lim SC,Kim J,et al. Effects of myricetin,an anticancer compound,on the bioavailability and pharmacokinetics of tamox-ifen and its main metabolite 4-hydroxytamoxifen,in rats[J]. Eur J Drug Metab Pharmacokinet,2011,36( 3) : 175-182. [36] Lee W,Woo ER,Choi JS. Effects of myricetin on the bioavail-ability of carvedilol in rats[J]. Pharm Biol,2012,50( 4) : 516-522. [37] 游璐茜,吴 振,赵玉芬. 檵木中槲皮素、山奈酚和杨梅素含量的高效液相色谱法测定[J]. 化学通报,2009,( 10) : 896-900. [38] Patel KG,Patel VG,Patel KV,et al. Validated HPTLC method for quantification of myricetin in stem bark of Myrica esculenta Buch. -Ham. ex D. Don,Myricaceae[J]. J AOAC Int,2010,3 ( 5) : 1422-1427. [39] Kumar A,Malik AK,Tewary DK. A new method for determina-tion of myricetin and quercetin using solid phase microextraction-high performance liquid chromatography-ultra violet / visible sys-tem in grapes,vegetables and red wine samples[J]. Anal Chim Acta,2009,631( 2) : 177-181. [40] Guo JM,Xue CF,Duan JA,et al. Fast characterization of con-stituents in HuangKui capsules using UPLC-QTOF-MS with colli-sion energy and massfragment software[J]. Chromatographia, 2011,73( 5 /6) : 447-456. [41] 徐欣荣,何建波,程 萍. 黄酮醇抗氧化剂构效关系的电化学研究[J]. 食品科学,2010,31( 7) : 4-10. [42] 覃洁萍,陈卫卫,张 炜,等. 杨梅素分散片的制备及性能考查[J]. 中国药师,2008,11( 12) : 1420-1424. [43] 王乃平,覃洁萍,钟正贤,等.杨梅素滴丸和杨梅素分散片的抗血栓作用对比[J]. 广西中医学院学报,2008,11( 4) : 1-2. [44] Landi-Librandi AP,de Oliveira CA,Azzolini AE,et al. In vitro evaluation of the antioxidant activity of liposomal flavonols by the HRP-H2O2-luminol system[J]. J Microencapsul,2011,28( 4) : 258-267. [45] 王晓云,姜子涛,李 荣. 环糊精及其衍生物与天然抗氧化剂杨梅素的包合作用研究[J]. 食品科学,2008,29( 5) : 125-128. [46] 张颖慧,王淑君,徐 琨,等. 杨梅素微乳的制备及质量评价[J]. 沈阳药科大学学报,2010,27( 10) : 777-783。 |







 杨梅素的研究进展
杨梅素的研究进展