| 离子交换纤维纯化绿原酸的研究 |
| 发布时间:2011-05-19 信息来源:admin 发布人:admin 点击次数:2785 |
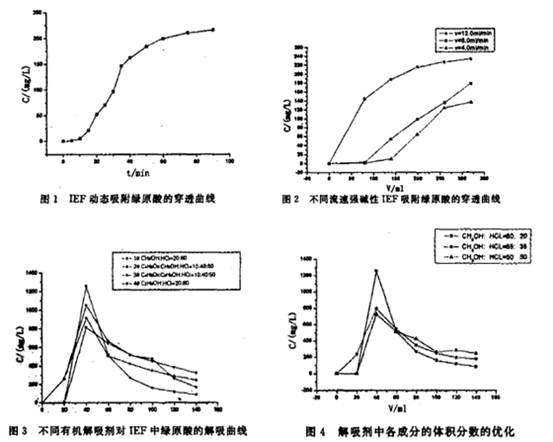
摘要:目的 对金银花中绿原酸的提取工艺进行研究。方法以乙醇为溶剂,采用动态吸附实验考察优化的吸附一解吸条件。结果 离子交换纤维提取绿原酸的优化工艺务件为:吸附时间60min,流速4.0 ml·min-1,解吸时以甲醇一盐酸(1mol·L-1 )一4:l混合溶液作为解吸剂,流速为0.8ml·min-1。结论 离子变换纤维应用于绿原酸的提取中效果好,适宜于产业化生产。 关键词:离子交换纤维 绿原酸 提取 引言 绿原酸(chlorogenic acid,CGA),化学名称为3—0一咖啡基一d一奎宁酸[1]。在医学上具有抗菌、消炎、利胆、保肝、降压、兴奋中枢神经等功效[2] 。绿原酸还是重要的化学试剂,在食品工业和生理生化分析中具有广泛的应用[3]。绿原酸25℃时在水中饱和浓度约为4 ,易溶于甲醇、乙醇等极性溶剂,徽溶于乙酸乙酯[4]. 目前,从植物中提取绿原酸的主要方法有溶刺提取法、大孔树脂吸附法、超声波提取法、超临界COz萃取法、超滤膜分离法等[5]。 离子交换法用于绿原酸的分离有其独到的优点,仅用少量解吸液就能达到浓缩分离的目的.已有研究[6]表明,强碱性离子交换纤维(ion exchage fiber,IEF)是含有羧基的小分子有机物、多酚化合物的良好吸附剂。本文提供了提取纯化绿原酸的一种有效方法,即离子交换纤维提取法。李明愉等[7]研究了强碱性IEF吸附绿原酸的吸附动力学和热力学特征,对本文研究有很好的指导作用。 2 实验 2.1实验材料及仪器绿原酸标准品,美国SIGMA公司I色谱纯甲醇和乙腑。百灵威化学试剂公司1分析纯甲醇,北京化学试剂公司I金银花粗提物(绿原酸含量5.85 ),北京生态尔公司;cl一型阴离子交换纤维,桂林正翰科技公司I岛津Lc一10AVP高效液相色谱仪I岛津分析天平I离子交换柱,内径16mm。 2.2 HPLC检测绿原酸的色谱条件及绿原酸的标准曲线方程HPLC条件[8]为IShimadzu Cl8色谱柱(5lμm,250×4.6mm),紫外检测器,波长326nm!柱温35℃;流速1.0 ml·min-1。流动相。水一乙腑一冰醋酸为88:10:2。绿原酸的标准曲线方程l A =54890C+7070.34,相关系数r≈0.999013(A为积分值峰面积。C为绿原酸的浓度,mg·L-1)。在0.0500~131.2 mg·L-1范围内,绿原酸浓度与积分面积呈皂好的线性关系. 2.3实验方法 2.3.1动态吸附的穿透曲线t准确称取1.9165g干纤维及金银花粗提物 1.9085g,加水制成500ml溶液.室温下纤维湿法装柱,装柱长度8.0 cm,溶液过柱。流速5.0ml·min-1 。 用HPLC检测不同时刻流出液中绿原酸的浓度,得到绿原酸的动态吸附的穿透曲线(见图1)。 2.3.2溶液流速的影响:准确称取1.7947g干纤维三份,湿法装柱,纤维装柱长均为7.5cm,称取1.6058g金银花粗提物三份,将制成500ml水溶液,将溶液过柱,流速分别为4.0 ml·min-1、6.0 ml·min-1、12.0 ml·min-1 ,作出强碱性IEF吸附绿原酸的穿透曲线(见图2). 2.3.3解吸条件的选择及优化按2.3.1的实验方法,控制流速为4.0 ml·min-1 ,将吸附完成后的离子交换柱用蒸馏水反复冲洗,至流出液无色,考察不同解吸剂、解吸荆中各成份的含量以及解吸时不同流速等因素对解析效果的影响(见图3~6)。
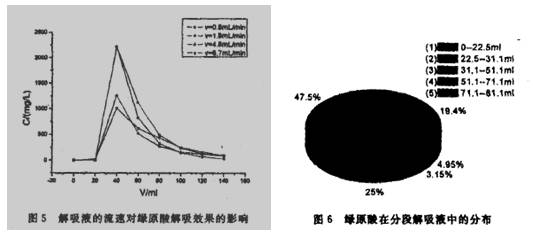
3 实验结果与讨论 3.1动态吸附的穿透曲线 由图1可见,绿原酸在强碱性IEF上吸附60min基本饱和,据文献啪报导,NKA一2型、HZ816型等大孔吸附树脂吸附绿原酸达到吸附平衡需4h,因此强碱性IEF对绿原酸的吸附速率是较高的。故在以下的动态吸附及解吸实验中选择吸附时间为60min(注t图中C为流出液中绿原酸浓度,下同). 3.2溶液流速的影响 从图2可以看出,在低流速4.0 ml·min州时,穿透点出现较晚,对绿原酸的吸附效率也较高。在较高流速12.0ml·min-1下,则表现为易于穿透。对绿原酸的吸附效率也较低。这是由于在较高流速时绿原酸在溶液中的扩散速度慢,来不及扩散到纤维表面,就已经流出固定床,故较容易穿透,因此较低流速有利予强碱性IEF对绿原酸的吸附.本实验确定在以下的研究中,溶液流经强碱性IEF离子交换柱时的流速为4.0 ml·min-1。 3.3解析条件的选择及优化 3.3.1解吸液组成的选择t本文所采用的IEF是强碱性的,极性较强.绿原酸易溶于甲醇、乙醇、乙酸乙酯等有机溶剂,参考文献[10,11]分别选用了上述几种溶剂与一定浓度的盐酸组成解吸剂,并分别作出相对应的解吸曲线。 由图3可见,采用甲醇一盐酸(1mol·L-1)=4 : 1混合溶液作为解吸剂时,对绿原酸在强碱性IEF上解吸效果较好。而乙醇与盐酸的混合溶液作解吸剂时效果较差,这是因为甲醇的盐酸溶液的极性较大,乙醇的极性较甲醇小,不利于极性较强的绿原酸从强碱性IEF上解吸。本文还考察了纯乙醇作为解吸剂的洗脱效果,解吸率远不如含乙酸乙酯、乙醇和盐酸的2#混合解吸剂.放本文采用1#解吸溶液作为解吸剂,若考虑到甲醇的毒性,也可以采用2#解吸剂。 3.3.2解吸液中各成分体积分数的优化: 由图4可见。古盐酸组分较高的解吸剂所对应的解吸曲线峰值不突出。且曲线峰拖尾现象较为明显。由甲醇一盐酸(1 mol·L-1 )(体积比4 :1)混合溶液组成的解吸液解吸效果较好,解吸剂为CH2OH—HCI一80:20就基本上可以将吸附在强碱性IEF上的绿原酸解吸下来。 3.3.3解吸液流速的选择:以3.3.2实验选择的解吸剂,选取四组不同的流速进行实验,从图5结果。流速对解吸效果影响显著,解吸液流速为0.8 ml·min-1时,解吸效果好,浓缩比也更高,通过计算,解吸所测得峰值所对应于原吸附溶液浓缩倍数达6.9倍。本研究所得解吸条件为采用甲醇一盐酸(1 mol ·L-1 )=4:1混合溶液作为解吸剂。流速为0.8 ml·min-1.
图6显示了在不同体积段解吸剂中绿原酸的分布情况,按照上述解吸方法,用48.6ⅡIl的解吸液就可以将绿原酸解吸下来,通过计算,总解吸效率为(0.02034+o.03872+o.01583)/(218.15*500*1O一6)=68.66% (注:总解吸效率一所取体积解吸液中的绿原酸的量/吸附原溶液中绿原酸的量).由此可见,采用强碱性IEF纯化粗提物中的绿原酸,工艺较为简单,绿原酸的得率也较高。是一种较为理想的提取方法. 4 结论 本文将强碱性IEF应用于绿原酸的提取中,吸附速度快。效果也较好.考察了吸附原液的流速对吸附效果的影响,得到了优化的吸附条件,通过考察绿原酸吸附的解吸液。得到了较为理想的解吸液以及解吸条件,即采用体积比甲醇一盐酸(1 mol·L-1 )=4 :1混合溶液作为解吸荆,流速为0.8 ml·min-1 ,其对应的解吸曲线基本不拖尾,浓缩比高,明显高于聚酰胺柱层析纯化方法[13]。研究结果显示,强碱性IEF分离法更适合于绿原酸粗品的纯化.。 参考文献 [1]高锦明,张鞍是,张康健.等.绿原酸分布、提取与生物活性研究综述.西北林学院学报.1999。14(2)t73~82. [2]陈少洲,吕飞杰.台建样.萎粕中绿原酸的研究进晨与应用.食品与发酵工业,2002。11t51~54. [3]尉芹,景谦平,马希汉.杜仲中绿原酸提取工艺条件的研究.林产化学与工业,2001,21 t27~32. [4]邓良,囊华,喻宗远.绿原酸的研究进晨.化学与生物工程, 2005,7l4~6. [5]刘军海,裘爱泳.绿原酸及其摄取纯化和应用前景·食品与油脂,2003,9t44~46. [6]李明愉,冯长根,曾庆轩.离子交换纤维吸附绿原酸特性的研究.功能材料。2005,6t884~887. [7]事明愉,曾庆轩,冯长根,等.离子交换纤维对阿魏酸的吸附和解吸研究.中国药学杂志,2005,1·40~43. [8]彭密军.杜仲叶中绿原酸的提取分离及含量测定.林业科技.1999.24(6)l41~42. [9]刘军海,裘爱泳.牡仲叶中绿原酸的摄取及精1_I.山东医药。2004.44(a_2)l7~9. [10]李进飞,黄可龙,李春华.NKA一9型树脂对绿原酸原酸吸附分离性能的研究.华西药学杂志,2004,19(1),1~4. [11]彭密军,周春山,钟世安。等.御鲁翻高教液相色谱法分膏纯化绿原酸.中南大学学报(自然科学版).2004.35(3)·408~412. [12]刘军海。茬爱泳.缀原酸的摄取分膏及古量潮定.中目油脂.2005,3O(3)。54~ 54 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 淫羊藿苷 二氢杨梅素 獐牙菜苦苷 杨梅素 10-羟基喜树碱 7-乙基-10羟基喜树碱 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 离子交换纤维纯化绿原酸的研究
离子交换纤维纯化绿原酸的研究