| 杨梅树皮素诱导人肝癌HepG2细胞凋亡机制的研究 |
| 发布时间:2011-04-28 信息来源:admin 发布人:admin 点击次数:3516 |
|
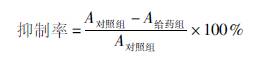
摘要:探讨杨梅树皮素(myricetin,MYR)对人肝癌HepG2抑制生长和诱导凋亡作用及其机制。:MTT法研究MYR对人肝癌HepG2的抑制生长;荧光染色和电子透射电镜观察HepG2细胞形态;流式细胞仪研究MYR对HepG2细胞周期的影响及诱导凋亡作用,罗丹明123单染观察MYR对线粒体膜电位的改变;caspase3,9试剂盒检测MYR对人肝癌HepG2细胞内caspase3,9活性的影响。:MYR对人肝癌HepG2细胞生长具有明显的抑制作用,并具有剂量依赖性,IC50为586617mg·L-1;MYR作用72h后,HepG2细胞呈现典型细胞凋亡特征,细胞周期阻滞于G2/M期,凋亡率最高为6473%。同时线粒体膜电位明显下降,caspase3,9活性增加。:MYR对人肝癌HepG2细胞有明显的抑制生长和诱导凋亡作用,其机制可能与线粒体凋亡途径有关。 关键词:杨梅树皮素;HepG2细胞;细胞凋亡;膜电位;caspase3,9 杨梅树皮素(myricetin,MYR)是从藤茶Ampelopsisgrossedntata茎叶中或杨梅树皮和树叶中提取的有效成分之一,为黄酮类化合物[1]。在人类白血病细胞HL60中,杨梅素通过诱导细胞凋亡降低肿瘤细胞活性,从而抑制肿瘤的生长[2]。但其对人肝癌HepG2细胞增殖抑制作用及机制尚未见报道。 为此本实验选取HepG2细胞为研究对象,采用MTT比色法、流式细胞术和分光光度法,通过观察MYR对HepG2细胞凋亡、线粒体膜电位和caspase3,9活性影响,初步探讨MYR诱导HepG2细胞凋亡的分子机制,为深入研究其在肿瘤方面的功效提供一定的理论基础。 1 材料 11 药物与试剂 人肝癌细胞HepG2(由哈尔滨商业大学药物研究所博士后科研工作站传代保种)。杨梅树皮素(徐州弘康科技有限公司,纯度为90%)。小牛血清(Hyclone公司);噻唑蓝(MTT,Ameresco公司);戊二醛(北京化工厂);RNA酶(Sigma公司);RPMI1640培养液(Gibco),Hochest33258(062010),碘化丙啶(PI),罗丹明123均为Invitrogen公司产品;caspase3,9试剂盒(北京碧云天生物科技有限公司)。 12 仪器 酶标仪(瑞士TECAN公司),荧光显微镜(德国Leica公司),倒置显微镜(Olympus公司),流式细胞仪CLOUTEREPICSXL(美国BeckmanCoulter公司)。 2 方法 21 HepG2细胞培养 用含10%小牛血清的RPMI1640培养液,在5%CO2,37℃培养,细胞呈贴壁生长,用025%的胰酶消化传代,用于实验的细胞均处于对数生长期。 22 MTT法检测杨梅树皮素对HepG2细胞的生长抑制作用[3] 将对数生长期的细胞,调整细胞为1×104个/mL,按每孔1000个接种于96孔板,每孔100μL。次日加入MYR(终浓度分别为20,40,60,80,100,120,140mg·L-1),溶剂对照组及阳性对照组阿霉素10mg·L-1,每孔加100μL,培养72h,弃上清,每孔加100μL的05g·L-1MTT,继续培养4h,弃上清,每孔加200μLDMSO溶解MTT甲簪沉淀,用酶标仪在参考波长450nm,检测波长570nm条件下测定吸光度值A,计算肿瘤细胞的抑制率。
23 荧光显微镜法观察细胞形态[4] 取指数生长期的人肝癌细胞HepG2,调整细胞为3×105个/mL,于6孔板中每孔接种1mL。24h后试验组加入MYR(使其终浓度分别40,60,80,100mg·L-1);阿霉素10mg·L-1;对照组加入同体积培养液。继续培养72h后,PBS洗1遍,加固定液(甲醇冰醋酸3∶1),4℃固定10min后,加入5mg·L-1的荧光探针Hoechst33258,置培养箱中孵育15min,取出盖玻片,置于荧光倒置显微镜上观察细胞形态。 24 透射电镜法观察细胞状态[5] 收集细胞,冷PBS洗2次,4%戊二醛固定,1500r·min-110min,加入琼脂搅匀,冷却后切块,1%四氧化锇固定,醋酸铀和柠檬酸铅双重染色后,透射电镜观察细胞状态。 25 细胞周期分布和凋亡比例检测[6] 取指数生长期的人肝癌细胞HepG2,调整细胞为3×105个/mL,于6孔板中每孔接种1mL。24h后试验组加入MYR(使其终浓度分别40,60,80,100mg·L-1);阿霉素10mg·L-1;对照组加入相同体积的培养液。72h后,收集作用到预定时间的HepG2细胞,70%冷乙醇4℃固定过夜。固定后的细胞用PBS洗2遍并悬浮之,加入PI染液(终浓度为50mg·L-1),37℃避光温育30min,用流式细胞仪检测,计算出细胞周期分 布和凋亡情况,激发波长488nm,发射波长630nm。 26 线粒体膜电位检测[7] 取指数生长期的人肝癌细胞HepG2,加入适量025%胰蛋白酶液消化细胞,使贴壁细胞脱落。用含10%胎牛血清的培养基制备成3×105个/mL的细胞悬液,于6孔板中每孔接种1mL。将平板置于37℃,5%CO2培养箱。24h后加入MYR(使其终浓度分别为40,60,80,100mg· L-1);阿霉素10mg·L-1;阴性对照组加入不含药物相同体积的培养液。72h后细胞用胰酶消化,加PBS洗2遍,分别加入终浓度10μmol· L-1的罗丹明123置于37℃孵育30min,孵育后离心(2000r·min-1,10min),用PBS洗2次,再用300目尼龙网过滤后用流式细胞仪检测细胞荧光强度,激发波长488nm,发射波长525nm。 27 caspase3,9活力的检测[8] 取指数生长期的人肝癌细胞HepG2,加入适量025%胰蛋白酶液消化细胞,使贴壁细胞脱落。用含10%胎牛血清的培养基制备成密度为3×105个/mL的细胞悬液,于6孔板中每孔接种1mL。将平板置于37℃,5%CO2培养箱。24h后不同浓度的RES,使其终浓度分别40,60,80,100mg· L-1;阿霉素10mg·L-1;阴性对照组加入不含药物相同体积的培养液。药物作用72h后利用caspase3,9试剂盒检测caspase3,9的活性。 3 结果 31 杨梅树皮素对HepG2细胞的生长抑制作用 结果显示MYR对HepG2细胞具有生长抑制作用并具有明显的剂量依赖性,其IC50值为58.6617mg·L-1(表1)。
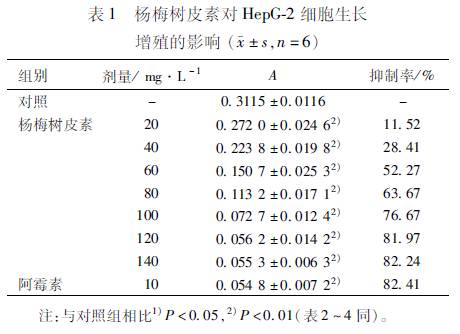
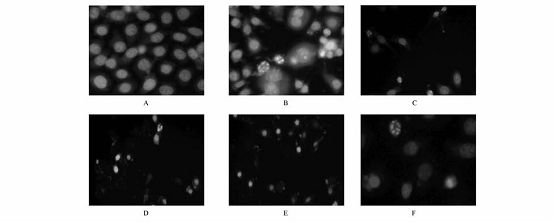
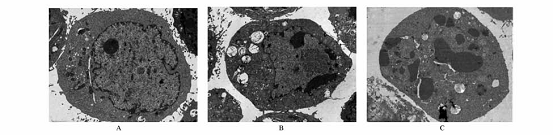
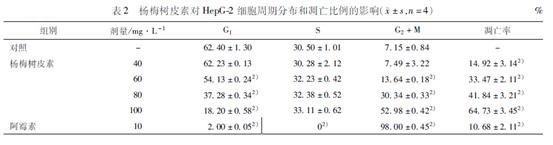
32 杨梅树皮素对HepG2细胞形态学改变的影响 HepG2细胞随MYR作用浓度的增高出现不同程度的凋亡改变,荧光显微镜下对照组细胞核形状正常,呈圆形,染色均匀,其核内染色体呈均匀分布;而MYR作用HepG2细胞72h后,其细胞核固缩、凝聚,出现浓染致密的颗粒块荧光。透射电镜进一步显示细胞部分核膜向外膨出,胞质有大小不等的空泡,微绒毛数量减少,线粒体、粗面内质网等细胞器减少(图1,2)。 33 流式细胞仪检测HepG2细胞凋亡和细胞周期变化 流式细胞术检测显示,不同浓度的MYR(40~100mg·L-1)作用HepG2细胞72h后可引起HepG2肿瘤细胞凋亡。MYR作用72h后,G1期细胞的比例减少,S期细胞的比例无明显影响,G2期细胞的比例增加,表明杨梅树皮素对HepG2细胞周期的G2/M期有一定的阻滞作用,并且能诱导其凋亡并呈明显的剂量依赖性(表2)。
A对照组;B杨梅树皮素40mg·L-1;C杨梅树皮素60mg·L-1;D杨梅树皮素80mg·L-1; E杨梅树皮素100mg·L-1;F阳性对照组。 图1 荧光显微镜观察杨梅树皮素对HepG2细胞形态学改变的影响 A
A对照组;B杨梅树皮素60mg·L-1;C杨梅树皮素100mg·L-1。 图2 电子透射电镜观察杨梅树皮素对HepG2细胞形态学改变的影响(×6000
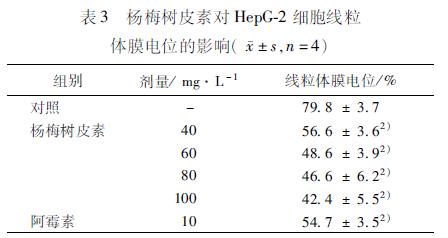
34 杨梅树皮素对HepG2细胞线粒体膜电位的影响 细胞经罗丹明123染色,流式细胞仪检测,结果显示经不同浓度MYR作用后的HepG2细胞与空白对照组相比(空白组的荧光强度为798%)线粒体膜电位显著降低。各剂量组的荧光强度分别为566%,486%,466%,424%,阳性对照组(阿霉素10mg·L-1)的荧光强度为547%(表3)。
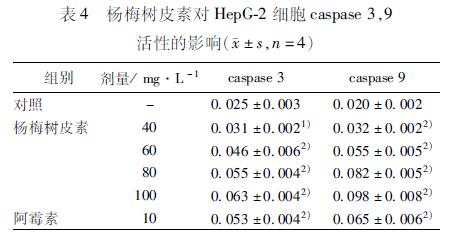
35 杨梅树皮素对HepG2细胞caspase3,9活性的影响 经不同浓度MYR作用后的HepG2细胞中caspase3,9活性增加。正常情况下caspase3,9活性水平较低,A405值分别为0025和0020,在MYR作用下,其活性升高,A405分别升至为0031,0046,0055,0063和0032,0056,0083,0098,与空白对照组相比,差异有统计学意义(P<005)(表4)。 4 讨论 近年来,寻找有效的抗肿瘤天然药物成为研究的热点之一,许多文献[910]报道杨梅素对多种肿瘤具有杀伤作用,在临床上用于治疗食管腺癌、结肠癌等多种癌症。体外实验研究表明MYR对HepG2细胞有明显的抑制作用,且存在剂量效应关系;通过光镜、电镜形态学观察,可见胞体缩小,胞浆凝缩,核内染色质从均匀分布逐渐凝集成新月状,附
在核周边,密度明显增高,界限清楚、胞膜完整、内质网扩张、空泡化,表面微绒毛消失。流式细胞术是检测细胞凋亡的一种重要方法,通过PI染色法,流式细胞仪能检测到与PI标记细胞DNA结合的PI的荧光强度可直接反映细胞内DNA的含量,可以检测目标细胞内的DNA含量,区分细胞周期各时相。研究显示,随着MYR浓度的增加,HepG2细胞的亚二倍体细胞逐渐升高,并能在一定浓度范围内将细胞增殖阻滞在G2/M期,表现出细胞周期特异性;提示MYR能够减慢HepG2细胞分裂速度,阻止其由G2/M 期向G0/G1和S期移行,从而抑制HepG2细胞增殖。从表2可见,人肝癌HepG2细胞经MYR作用后,随着MYR浓度的增加,凋亡细胞比例也逐渐增多。 目前认为,细胞凋亡的信号转导与3条途径有关,一条是线粒体途径,由线粒体感受伤害刺激信号后释放一系列凋亡信号分子,引发caspase反应导向凋亡,其中线粒体是细胞凋亡调控中心[11];另一条是死亡受体途径,由死亡受体结合配体后直接激发caspase级联反应[12];还有一条内质网途径,目前机制不甚明确,估计与内质网应激诱导caspase反应有关[13]。本实验发现人肝癌HepG2细胞经MYR处理后,细胞内的线粒体膜电位明显下降,caspase3和caspase9活性也明显增加。 诱导细胞凋亡是抗肿瘤药物发挥作用的重要环节。本研究结果表明MYR能有效诱导人肝癌HepG2细胞凋亡,并可能通过线粒体途径实现,为进一步研究MYR抗肿瘤作用的分子药理机制提供了实验依据。但是MYR诱导HepG2细胞凋亡是否还存在其他重要机制还有待于更进一步的研究。 [1] 常徽,糜漫天植物黄酮抗肿瘤研究进展[J]国外医学·卫生学分册,2006,33(5):296 [2] KoCH,ShenSC,HsuCS,etalMitochondrialdependent,reactiveoxygenspeciesindependentapoptosisbymyricetin:rolesofproteinkinaseC,cytochromeC,andcaspasecascade[J]. BiochemPharm,2005,69(6):913 [3] 刘薇,林文翰,季宇彬青龙衣毒性作用及体外抗肿瘤作用的实验研究[J]中国中药杂志,2004,29(9):887 [4] 张小晶,刘云鹏,侯科佐,等紫杉醇诱导黑色素瘤细胞凋亡的研究[J]中国医科大学学报,2006,35(2):134 [5] 冯骥良,温巧莲,何伟玲,等白藜芦醇以Caspase依赖和非依赖两种方式导致Jurkat细胞死亡[J]细胞生物学杂志,2007,29:103 [6] 陈立军,靳秋月,王瑞珉,等芸香苷诱导K562细胞凋亡机制[J]中草药,2006,37(5):738 [7] 徐开屏,孙凤艳线粒体释放的促凋亡蛋白和细胞凋亡[J]中国神经科学杂志,2002,18(4):732 [8] NewmeyerD,FergusonMSMitochondria:Releasingpowerforlifeandunleashingthemachineriesofdeath[J]Cell,2003,112(4):481 [9] KoCH,ShenSC,LeeTJF,etalMyricetininhibitsmatrixmetalloproteinase2proteinexpressionandenzymeactivityin colorectalcarcinomacells[J]MolCancerTher,2005,4(2): 281 [10] ZhangQ,ZhaoXH,WangZJFlavonesandflavonolsexertcytotoxiceffectsonahumanoesophagealadenocarcinomacellline(OE33)bycausingG2/Marrestandinducingapoptosis[J] FoodChemToxicol,2008,46(6):2042 [11] MartinousJC,DesagherS,AntonssonBCytochromecreleasefrommitochondria:Allornothing[J]NatCellBiol,2000,2(3):41 [12] JohnstoneRW,RuefliAA,LoweSWApoptosis:Alinkbetweencancergeneticsandchemotherapy[J]Cell,2002,108(2):153 [13] NakagawaT,ZhuH,MorishimaN,etalCaspase12mediatesendoplasmicreticulumspecificapop tosisand cytotoxicityby amyfoidbeta[J]Nature,2000,403(6765):98 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 淫羊藿苷 二氢杨梅素 獐牙菜苦苷 杨梅素 10-羟基喜树碱 7-乙基-10羟基喜树碱 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 杨梅树皮素诱导人肝癌HepG2细胞凋亡机制的研究
杨梅树皮素诱导人肝癌HepG2细胞凋亡机制的研究