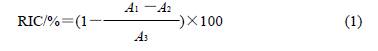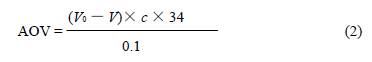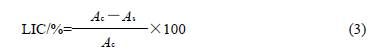| 酯化修饰对二氢杨梅素性能的影响 |
| 发布时间:2011-04-27 信息来源:admin 发布人:admin 点击次数:4470 |
摘 要:用月桂酰氯对二氢杨梅素进行不同程度的酯化修饰,探讨不同程度的酯化修饰对二氢杨梅素溶解性和抗氧化性能的影响。结果表明:与二氢杨梅素相比,二氢杨梅素酯化物在油中的溶解度提高20~300 倍,并且随着酯化程度加大,二氢杨梅素酯化物在油中溶解度增加。二氢杨梅素酯化物在极性溶剂中清除DPPH 自由基和H2O2 的能力比二氢杨梅素低,酯化物的抗氧化活性随着酯化程度的增加呈下降趋势;在铁离子- 抗坏血酸诱导的卵磷脂过 氧化反应体系中,二氢杨梅素酯化物的抗氧化活性明显优于二氢杨梅素,且不受酯化程度的影响,表明二氢杨梅素及其酯化物在卵磷酯脂质体中的抗氧化活性受溶解性和羟基数目双重影响。 关键词:二氢杨梅素;月桂酰氯;酯化反应;溶解性;抗氧化活性 二氢杨梅素(dihydromyricetin,DMY)是一种重要的黄酮类化合物,化学名称为3, 5 ,7, 3,4, 5- 六羟基黄烷酮醇[1],其分子以2- 苯基苯并吡喃环为结构基础,有6 个取代羟基,赋予其特殊的生理功能[2]。二氢杨梅素的生理功效主要表现在抗氧化[3-5]、抗菌抑菌[6-7]、防紫外线辐射[8-9]、促进细胞增殖[10]、保肝护肝[11-12]、抗肿瘤[13] 等方面,研究表明, 二氢杨梅素的这些功能与其清除自由基的抗氧化性能密切相关。 将二氢杨梅素的羟基进行酯化可以改善其脂溶性,提高其在油脂体系中的抗氧化活性[ 14 ]。但是,羟基数的减少会导致二氢杨梅素分子自身抗氧化活性降低[15]。因为黄酮类化合物在抗氧化过程中,主要是通过羟基与自由基反应生成较稳定的半醌式自由基,从而终止自由基链式反应[16]。为探讨分子修饰对二氢杨梅素性能的影响, 本实验用月桂酰氯对二氢杨梅素进行不同程度的酯化修饰,从产物溶解性及在不同氧化体系中产物抗氧化活性的变化方面,研究分子修饰对二氢杨梅素性质的影响,为揭示二氢杨梅素分子结构与活性之间的关系提供参考。 1 材料与方法 1.1 材料与试剂 藤茶,福建武夷山产,经鉴定为原植物;N,N- 二甲基甲酰胺、月桂酰氯、碳酸钠均为分析纯 国药集团化学试剂公司。 1.2 仪器与设备 UV1700紫外-可见光谱仪日本岛津公司;TENSOR27傅里叶变换红外光谱仪 德国Bruker 光谱仪器公司。 1.2 方法 1.2.1 制备二氢杨梅素 称取100g 藤茶,加2L 去离子水,加热至沸,小火煮30~60min。趁热过滤,将滤液自然冷却到室温,静置沉淀24h 以上。抽滤,滤渣在55℃下干燥,得二氢杨梅素粗品。将二氢杨梅素粗品用水重结晶5 次以上,得到纯度为95% 的二氢杨梅素。 1.2.2 制备二氢杨梅素月桂酸酯 将自制纯度为95%的二氢杨梅素溶解于N,N- 二甲基甲酰胺,加入一定量催化剂。搅拌下缓慢滴加一定物质量配比的月桂酰氯于反应体系。滴加完毕后,于40℃、搅拌下反应24~36h,反应过程中取样分析二氢杨梅素转化率。反应完毕后,用1g/100mL Na2CO3 水溶液洗去反应体系的酸性物质,用热水洗去未反应的二氢杨梅素及其他残留杂质,最后用冰水冲洗数次。将产品真空干燥,得到黄绿色或黄色蜡状物。紫外- 可见光谱扫描产品的光谱特性,红外光谱分析产品结构。 1.2.3 溶解度测定 在250mL 锥形瓶中加入色拉油50g 或100g 水,定量添加二氢杨梅素及其月桂酸酯化物,在45~50℃的水浴振荡器中振荡1h 后静置10h,观察溶解情况。若完全溶解则继续添加,直至有不溶物出现,离心除去不溶物。水中不溶物直接干燥后称质量。油中不溶物先用温水洗,将表面油洗掉,然后干燥,称质量。添加量减去不溶物量,即为溶解的质量。 1.2.4 DPPH 自由基清除实验 将二氢杨梅素及其月桂酸酯化物溶解于乙醇中,配成与二苯代苦味酰自由基(DPPH)溶液相同浓度,量取2.0mL样品液,滴加0.2mmol/L DPPH 乙醇溶液2.0mL,放置30min,以乙醇为空白,分别测定517nm 波长处吸光度。 按照公式(1) 计算自由基清除率(RIC)。
式中:A1 为空白样吸光度;A2 为2mL 待测试液与2mL 乙醇混合液吸光度;A3 为2mL DPPH 溶液与2mL 乙醇混合液吸光度。 1.2.5 清除H2O2 的实验 将二氢杨梅素及其月桂酸酯化物分别用乙醇配制成0.01mol/L 样品液。准确吸取样品液l.0mL,加入0.25mLl.0mol/L H2SO4 和5mL 0.25mol/L H2O2 水溶液,室温下反应10min,再加入10% KI 溶液20mL,暗处静置5min。用0.05mol/L Na2S2O3 滴定,以1%~2% 淀粉溶液指示终点测定I2 含量。按照公式(2)计算抗氧化值(AOV)。
式中:V0 为空白样消耗的Na2S2O3 体积/mL;V 为样品消耗的Na2S2O3 体积/mL;c 为Na2S2O3 的浓度/(mol/L)。 1.2.6 抑制脂质过氧化活性的测定 脂质体分散系(LLS)配制:称取300mg 卵磷脂,溶解于30mL pH7.4 的磷酸缓冲溶液中(10mmol/L),冰浴中振荡,使卵磷脂均匀分散于缓冲溶液中;三氯醋酸(TCA)- 硫代巴比妥酸(TBA)- 盐酸(HCl)混合液配制:称取15g TCA、0.375g TBA,依次放入100mL 水中,滴 加2.1mL 浓盐酸于其中。 测定步骤:于样品管中依次加入1.0mL卵磷脂溶液(LLS)、1.0mL 400μmol/L 的三氯化铁溶液、1.0mL 400μmol/L 抗坏血酸和1.2.4 节配制的样品乙醇液1.0mL,于37℃水浴放置60min,再加入2.0mL TCA-TBA-HCl 混合液,在90~100℃水浴中放置15min 后取出,迅速冷却,以2000r/min 转速离心10min,取上清液在535nm 波长处测定吸光度。空白管以1.0mL 蒸馏水代替1.0mL 样品,操作方法同样品管,测定空白管的吸光度。按照公式( 3 )计算抑制脂质过氧化的抑制率(LIC)。
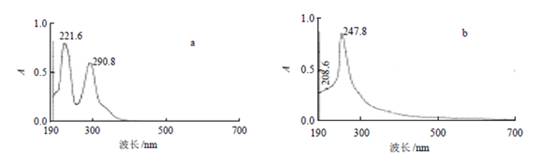
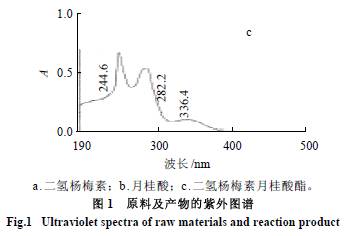
式中:As 为上清液的吸光度;Ac 为空白管的吸光度。 2 结果与分析 2.1 紫外- 可见光谱分析 由图1 可知,二氢杨梅素在291nm 波长处有特征吸收峰,月桂酸在247nm 波长有吸收峰,而二氢杨梅素月桂酸酯在291nm 波长处没有吸收峰,但在244nm 和282nm 波长处有吸收峰,此外酯化物在336nm 波长处有一较小吸收峰,而二氢杨梅素及月桂酸在此处均没有吸收峰。所以,从紫外吸收峰的变化可以初步判定产物的分子结构与二氢杨梅素是不同的。
2.2 红外光谱图分析
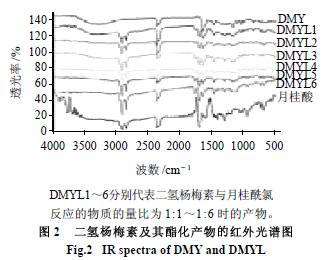
由图2 可知,在2850cm-1 和2920cm-1 处,二氢杨梅素月桂酸酯和月桂酸均有两个相连的吸收峰而二氢杨梅素分子无此吸收峰。这两处的峰是脂肪链的C - H 键伸缩振动吸收峰,即亚甲基的特征吸收峰,说明二氢杨梅素分子中已引入月桂酸脂肪链烃。二氢杨梅素酯化物在1770cm-1 处有吸收峰,此处为芳香族化合物羟基酯化后的酯键羰基的伸缩振动吸收峰。二氢杨梅素酯化物在1770cm-1 处的吸收峰可充分证明二氢杨梅素的羟基已与月桂酰氯发生了酯化反应。 2.3 二氢杨梅素及其酯化物在油和水中的溶解性
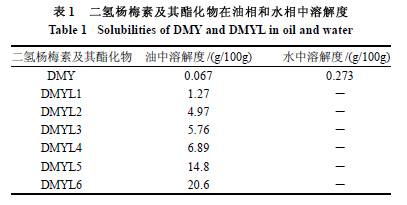
二氢杨梅素属于双氢黄烷酮醇,为非平面型分子,分子间排列不紧密,分子间引力比平面型分子小,所以有利于水分子的进入。此外,二氢杨梅素含有6 个亲水性羟基,亲水基团可以通过氢键结合的方式与水分子产生相互作用,使二氢杨梅素分子发生溶剂化或增溶作用。因此,二氢杨梅素在水中特别是在热水中具有较好的溶解性。当分子中引入疏水性的长链脂肪烃后,由于疏水基团与水分子产生斥力,会极大地降低其在水相中的溶解性,同时增大其在油相中的溶解性。由表1 可知,二氢杨梅素经过月桂酰氯酯化后,在水中的溶解度下降很多,均难溶于水。而在油中的溶解度提高了20~300 倍,并且随着酰化剂增大即酯化程度的加大,酯化产物在油中的溶解度也随之加大。 2.4 抗氧化活性 2.4.1 清除DPPH 自由基能力
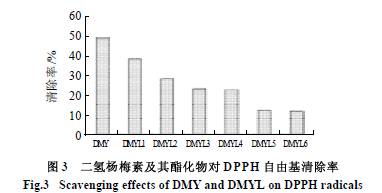
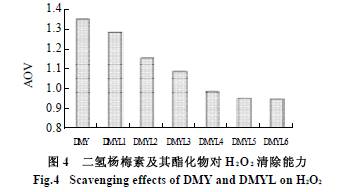
2- 苯基苯并吡喃环和羟基是二氢杨梅素分子抗氧化作用的结构基础。其中,2 - 苯基苯并吡喃环是抗氧化作用的结构依托,羟基是抗氧化作用的结合位点[2]。二氢杨梅素A 环上的碳原子与酚羟基及C 环上的氧原子形成大π键,电子分散于整个大π键体系中。同理,B环上的碳原子与B 环酚羟基的氧原子形成另一大π键。酚羟基的电子偏向共振π键,削弱了O - H 键,使质子H 易脱去成为氢供体,从而发挥其抗氧化作用。脱去H 的二氢杨梅素成为苯氧自由基,由于苯氧自由基氧原子上的不成对电子分散于整个共轭体系,使参与共轭的原子电荷分布均匀,成为稳定的自由基,终止了其进一步参与自由基链式反应。由图3 可知,随着月桂酰氯加入量的提高,二氢杨梅素酯化物对于DPPH 自由基清除率呈下降趋势。原因是游离羟基数目相应减少导致了其清除自由基能力的下降。 2.4.2 对H2O2 的清除能力 H2O2 是一种强氧化剂,在体内可诱发转变为羟自由基,使多种类型的细胞发生凋亡。 由图4 可知,二氢杨梅素酯化物清除H2O2 能力比二氢杨梅素差,并且随着酯化程度的增加,清除H2O2 的能力呈下降趋势。这说明羟基是二氢杨梅素抗氧化活性的主要基团,羟基数目越多,可提供的氢原子越多,抗氧化活性越强。 2.4.3 抗脂质过氧化活性
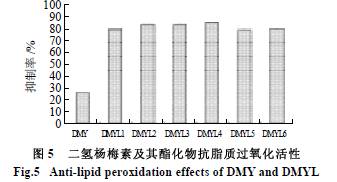
由图5 可知,在铁离子- 抗坏血酸诱导的卵磷脂过氧化反应体系中,二氢杨梅素酯化物的抗氧化活性显著优于二氢杨梅素。卵磷脂C2 上的脂溶性自由基位于双分子层的疏水区,二氢杨梅素分子中引入月桂酸链烃后,脂溶性增强,分子可以很容易伸入到卵磷脂双分子层的疏水区与脂溶性自由基接触,达到清除脂溶性自由基目的。而二氢杨梅素难以进入卵磷脂双分子层疏水区,不能与脂溶性自由基进行很好接触,导致其抑制脂质过氧化的能力不如酯化物。所以,介质微环境可以对物质的抗氧化活性产生重要作用。二氢杨梅素的酯化程度对其抗氧化活性影响不明显,这可能是因为其抗氧化活性受到分子中羟基数目和分子溶解性双重作用的影响。 3 结论 通过对二氢杨梅素进行分子修饰及比较二氢杨梅素与其分子修饰产物在不同体系中的抗氧化活性,发现二氢杨梅素及其酯化物的抗氧化能力与其所处体系密切相关。在DPPH 自由基清除实验和清除H2O2 实验中,二氢杨梅素酯化物的抗氧化活性比二氢杨梅素低,并且随着酯化程度的加大,酯化物的抗氧化性能呈下降趋势。 所以,在极性溶剂体系二氢杨梅素及其酯化物的抗氧化活性受分子中羟基数目的影响较大;在铁离子- 抗坏血酸诱导的卵磷脂过氧化反应体系中,二氢杨梅素酯化物的抗氧化活性明显优于二氢杨梅素,并且不受酯化程度的影响,说明二氢杨梅素及其酯化物在脂质体中的抗氧化活性受溶解性和羟基数双重影响。 参考文献: [1] ZHANG Yansong, ZHANG Qingying, LI Liying, et al. Simultaneous determination and pharmacokinetic studies of dihydromyricetin and myricetin in rat plasma by HPLC-DAD after oral administration of Ampelopsis grossedentata decoction[J]. Journal of Chromatography B,2007, 860: 4-9. [2] 李卫, 郑成, 宁正祥, 等. 二氢杨梅素的酯化及其抗氧化规律探讨[J].食品科技, 2007(5): 198-201. [3] MA J, YANG H, BASILE M J, et al. Analysis of polyphenolic antioxidants from the fruits of three pouteria species by selected ion monitoring liquid chromatography-mass spectrometry[J]. J Agric Food Chem, 2004,52(19): 5873-5878. [4] GAO Jianhua, LIU Benguo, NING Zhengxiang, et al. Characterization and antioxidant activity of flavonoid-rich extracts from leaves of Ampelopsis grossedentata[J]. Journal of Food Biochemistry, 2009, 33:808-820. [5] MA J, LUO X D, PROTIA P, et al. Bioactive novel polyphenols from the fruit of Manilkara zavessela (Sapodilla)[J]. J Nat Prod, 2003, 66(7):983-986. [6] HAYASHI T, TAHARA S, OHGUSHI T. Genetically-controlled leaf traits in two chemotypes of Salix sachalinensis Fr. Schm (Salicaceae)[J].Biochem Syst Ecol, 2005, 33:7-38. [7] ROSCHEK B Jr, FINK R C, McMICHAEL M D, et al. Elderberry flavonoids bind to and prevent H1N1 infection in vitro[J]. Phytochemistry,2009, 70: 1255-1261. [8] LAVOLA A, APHALO P J, LAHTI M, et al. Nutrient availability and the effect of increasing UV-B radiation on secondary plant compounds in Scots pine[J]. Environ Exp Bot, 2003, 49(1): 49-60. [9] RIITTA T, TIMO V, PEDRO J A, et al. Clonal differences in growth and phenolics of willows exposed to elevated ultraviolet-B radiation[J].Basic Appl Ecol, 2003, 4(3): 219-228. [10] TOWATARI K, YOSHIDA K, MORI N, et al. Polyphenols from the heartwood of Cercidiphyllum japonicum and their effects on proliferation of mouse hair epithelial cells[J]. Planta Med, 2002, 68: 995-998. [11] MURAKAMI T, MIYAKOSHI M, ARAHO D, et al. Hepatoprotective activity of tocha, the stems and leaves of Ampelopsis grossedentata, and ampelopsin[J]. Biofactors, 2004, 21(1/4): 175-178. [12] YABE N, TANAKA K, MATSUI H. An ethanol-extract of Ampelopsis brevipedunculata (Vitaceae) berries decreases ferrous iron-stimulated hepatocyte injury in culture[J]. J Ethnopharmacology, 1998, 59(3): 147-159. [13] 蒋才武, 李炳超, 唐乾利. 双氢杨梅素与G- 四链体的相互作用研究[J]. 化学学报, 2007, 65: 2159-2162. [14] 李卫, 郑成, 宁正祥. 二氢杨梅素月桂酸酯在猪油中的抗氧化性研究[J]. 食品科学, 2005, 26(9): 73-76. [15] 郭清泉, 林淑英, 李大光, 等. 二氢杨梅素抗氧化机制探讨[J]. 食品科学, 2006, 27(5): 121-123. [16] 张红雨. 黄酮类抗氧化剂结构活性关系的理论解释[J]. 中国科学: B辑, 1999, 29(1): 91-96.
杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 淫羊藿苷 二氢杨梅素 獐牙菜苦苷 杨梅素 10-羟基喜树碱 7-乙基-10羟基喜树碱 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 酯化修饰对二氢杨梅素性能的影响
酯化修饰对二氢杨梅素性能的影响