| 绿原酸人工抗原的合成及反应条件的优化 |
| 发布时间:2011-04-22 信息来源:admin 发布人:admin 点击次数:4433 |
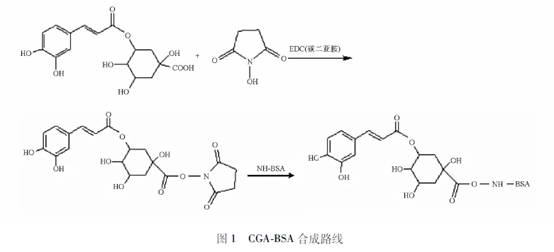
[摘要] 目的:制备中药成分绿原酸(CGA)的人工抗原,并优化合成反应条件,为中药注射剂不良反应的深入研究提供物质基础和技术基础。方法:采用碳二亚胺法,将CGA与载体蛋白牛血清白蛋白(BSA)偶联起来制得完全抗原(CGABSA);正交法优化合成反应条件;经基质辅助激光解吸飞行时间质谱(MALDITOFMS)和紫外吸收光谱(UV)测定其偶联率(Mr)。结果:MALDITOFMS和UV测得合成的人工抗原CGABSA的Mr分别为20和188;反应最佳条件为NHS,EDC,BSA与CGA的比率为4∶1,1∶1,1∶200,pH为9。结论:成功合成了绿原酸全抗原(CGABSA),为进一步深入研究绿原酸的过敏原性及其相关性研究提供物质基础。 [关键词] 绿原酸;基质辅助激光解吸飞行时间质谱;完全抗原 中药注射液不良反应主要为I型变态反应,变态反应相对较多地出现在清热解毒类的中药注射剂中,首先与这些品种较高的临床应用率是相关的,其次跟它们共有的内在主要成分绿原酸(CGA)是否相关,是否是其致敏原的问题,越来越受到关注和重视,值得笔者深入探讨。CGA在众多的中药注射剂如双黄连注射液、茵栀黄注射液、银黄注射液、清开灵注射液等中均存在,具有抗菌、抗病毒、利胆等作用,是中药抗感染类注射剂的有效成分之一。由于CGA是植物次生代谢产物,在植物中广泛分布,从厥类植物到高等双子叶植物均有报道,且其极性较大,水溶性较好,虽然CGA在一些注射剂中不是活性成分,但工艺中有可 能未将其除去而含有CGA[1]。从CGA的结构、存在形式、理化性质分析,存在致敏的可能。相对分子质量低于1000的化合物,可以与蛋白质结合形成半抗原载体复合物,有人认为,以CGA为代表的邻苯二羟基类成分是半抗原物质,经一定反应,与蛋白质的结合后具有致敏性;15~18分子或40分子的CGA(2种反应机制)与1分子人类血清蛋白结合,成为具有高度抗原性的结合物[24],也有研究者认为,绿原酸不具有致敏作用[56]。虽然CGA是否为变应原尚无确切定论,但凡是含有CGA且供静脉滴注用的中药注射剂,容易发生过敏反应,却是不争的事实。 本研究通过制备CGA与蛋白的结合物,即合成绿原酸全抗原(CGABSA),设计讨论其反应条件的优化;并采用紫外光谱和基质辅助激光解吸飞行时间质谱(MALDITOFMS)测定其偶联率(Mr),为进一步深入研究中药注射剂不良反应(主要是I型变态反应)的相关性基础研究提供物质基础。 1 材料与方法 1.1 试剂与仪器 CGA(纯度≥98.0%,北京化学试剂公司);牛血清白蛋白(BSA,北京索莱宝科技有限公司);碳二亚胺盐酸盐(EDC·HCL纯度≥99.0%,北京化学试剂公司);N羟基琥珀酰亚胺(NHS);二甲基甲酰胺(DMF)均为分析纯,北京化学试剂公司;磷酸盐缓冲液(PBS,pH7.2,0.01mol·L1);MALDITOFMS(美国布鲁克道尔顿有限公司);紫外可见分光光度计(UNICO2800,美国)。 1.2 CGABSA合成方法CGABSA人工抗原的合成参照文献[7]方法进行,CGA 17.0mg,EDC· HCL42.0mg,NHS18.0mg,溶解于3mLDMF中,避光密封,室温反应24h后得A液;BSA50.0mg溶于7mLPBS中为B液。然后将A液逐滴加入B液中,密封避光4℃下搅拌过夜;上述反应完成后,反应液转移至透析袋于4℃搅拌下用PBS透析3d;经冻干处理,即得到CGABSA复合物,于-20℃保存备用合成路线见图1。
1.3 合成条件的优化 分析影响合成的所有因素,确定其主要因素有NHS,EDC及BSA与CGA的比例(摩尔比),以及反应体系的pH,设计L9(34)的正交试验表进行试验。 1.4 CGABSA人工抗原偶联率的计算 1.4.1 基质辅助激光解吸飞行时间质谱(MALDITOFMS)[8] 供试品处理:称取CGABSA06mg,溶于8mol·L-1的尿素30μL中,然后将它稀释成适当的浓度。称取BSA10mg溶于水50μL。基质辅助溶液的配制:将015%TFA34μL加到乙腈17μL中,再加入适量的芥子酸使溶液达到过饱和状态,超声15min,1000r· min-1离心3min,备用。 MALDITOFMS测定:各取供试品和基质辅助溶液1μL,充分混匀,吸取混合液1μL滴加在金属点样板上,室温凉干后,上MALDITOFMS测定。 MALDITOFMS的仪器工作条件为:N2激光337nm,4次/s脉冲,加速电压20kV,真空度5×10-9KPa,真空管长度为15m,线性模式下操作,所得数据用BrukerXMASS软件分析。 1.4.2 紫外吸收光谱法 制备不同质量浓度 (32,64,128,256,512mg·L-1)CGA对照品溶液,在278nm处测定紫外吸收值,得回归方程。 对偶联物(200mg· L-1),BSA对照品溶液(200mg· L-1)进行紫外扫描,水为对照。CGABSA为200mg·L-1,在278nm处吸收值为A1,BSA为200mg·L-1时,在278nm处的吸收值为A2,那么A1~A2则是CGA在此波长处的贡献。根据回归方程可得出偶联物中对应的CGA的质量浓度,根据公式即可计算出Mr。
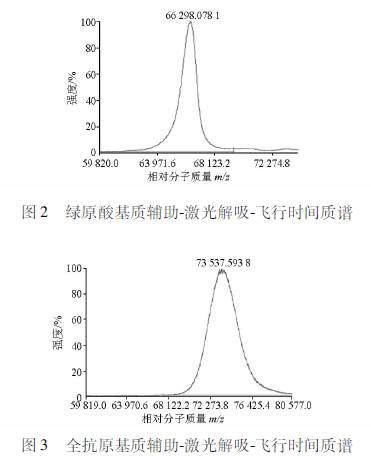
2 结果 2.1 CGABSA人工抗原的MALDITOFMS鉴定图2和图3分别为BSA和CGABSA的质谱图。可知BSA的相对分子质量为66298,CGABSA 的相对分子质量为73538,已知CGA的相对分子质量为354,该结果表明CGABSA中,每个载体蛋白BSA分子上偶联有20个[(73538-66298)/354≈20]CGA分子,人工抗原的合成成功可用于进行相应的变态反应基础研究。
2.2 CGABSA人工抗原的紫外分析不同浓度CGA对照品溶液在278nm处的紫外吸收值,以质量浓度C(mg·L-1)为横坐标,吸光度A为纵坐标,计算回归方程。结果表明CGA在3.2~51.2mg·L-1的紫外吸收值与浓度有很好的线性关系,回归方程为A=0.0253C-00012,r=0.9999。 合成的CGABSA人工抗原A1 =0630,BSAA2=0.106,根据公式A1-A2=0.524,根据回归方程A=0.0253C-0.0012,r=0.9999,可得出偶联物中对应的CGA的质量浓度20.7mg·L-1,得出Mr约为18.8(18.8∶1)。 2.3 抗原合成条件的优化结果 从研究数据得出,无论EDC与CGA比例是1∶1,2∶1还是4∶1,其中的EDC都是等量或充分过量的,CGA几乎可以完全反应,所以对反应的影响最小;NHS与CGA的比例增加,Mr也在增加;本实验中pH为9时,Mr的范围均在理想的推荐范围(5∶1~20∶1),确定反应体系的最佳pH为9。 3 讨论 国内外对CGA的研究主要集中在药效学研究,而对CGA致敏性的研究,国外研究集中在20世纪60年代,加拿大的Freedman研究小组和美国的Layton研究小组对CGA的致敏性进行了研究,并在此期间发表了系列文献,他们对于CGA是否为变应原呈相反的两方面意见,前者认为是变应原,而后者认为不是变应原。对上述2个小组的研究文献综合分析,对于CGA是否为变应原尚无确切定论。缺乏系统的试验;受试物的纯度问题;试验方法不同等,可能是导致双方结果不一致的原因[3,6]。以后对此问题基本无报道,国内则无相关报道。 CGA是一种羧基半抗原,相对分子质量为354.30,低于1000,本身并不具备免疫原性,必须将其与具有免疫原性的载体蛋白相偶联生成完全抗原[9]。本研究将绿原酸(CGA)与载体牛血清白蛋白(BSA)偶联,制备CGA与蛋白的结合物,即合成绿原酸全抗原(CGABSA),为观察CGABSA的致敏作用提供物质基础,确定CGA是否为变应原。 对于羧基半抗原与载体的偶联,传统的人工抗原的合成方法有混合酸酐法、活泼酯法及碳二亚胺法。本实验采用碳二亚胺法合成CGABSA,由于CGA分子结构中的羧基可用于偶联反应,采用碳二亚胺法合成方案的优点是可以避免载体蛋白自身的氨基和羧基在交联剂作用下发生的自身交联,从而最大程度地减少反应副产物的生成促进剂,偶联效果较好。 然而,抗原的免疫原性不仅与抗原的分子结构大小有关,还与半抗原与载体蛋白偶联率的大小有关。连接过多的半抗原,并不意味着实际的免疫效果就一定好,半抗原与载体的偶联比(Mr)存在着最佳范围(5∶1~20∶1)[10],为得到理想偶联率的高免疫原性全抗原,笔者对合成条件进行了的多次优化试验。本实验中,反应中pH的变化会使反应中蛋白质不稳定产生沉淀析出,NHS直接影响取代从而影响蛋白质和抗原的连接,结合反应中出现的现象及实验数据分析,NHS的量和pH是影响偶联率的重要因素,因此,4个影响因素作用的大小顺序是NHS与EDC的比>反应的pH>CGA与BSA的比>EDC与CGA的比。笔者认为本反应的最佳条件是:NHS,BSA,EDC与CGA的比分别为4∶1,1∶200和1∶1及反应的pH为9,以此条件合成的CGABSA,其半抗原与载体蛋白的结合比从2∶1升高至14∶1。 此外,本实验采用MALDITOFMS测定人工抗原CGABSA的Mr,与传统的鉴定方法紫外光谱扫描法进行了比较,MALDITOFMS技术具有高灵敏度,供试品消耗量低,结果直观、准确(误差小于02%)的优点,现有紫外光谱扫描法对CGABSA复合物的测定,操作较简单易行、但所需样品量多,误差也较大;结果表明2种方法测得的数据比较接近,但是MALDITOFMS结果更为精确、可信。 MALDITOFMS法是比较理想的用于生物大分子的鉴定分析方法[8]。 本研究合成效率较高,合成方法简便可行,为进一步对CGA的致敏性及其发生机制、毒理学进行系统深入的研究,为寻找合适、敏感的方法对中药注射剂变态反应的研究提供了物质基础,也可为其他小分子物质的人工抗原合成提供参考。 [参考文献] [1] 赖宇红,陈浩桉,杨卫荣.中药注射剂变态反应研究亟待加强[J].中药新药与临床药理,2002,13(5):324. [2] FreedmanSO.Antigenicpropertiesofchlorogenicacid[J].JAllergyClinImmunol,1964,35:97. [3] FreedmanSO,etal.Chlorogenicacid:anallergeningreencoffenbean[J].Nature,1961,192:241. [4] 杨慧,刘志刚,韩庆国,等.艾蒿、青蒿花粉变应原组分的研究 [J].免疫学杂志,2004,20(2):120. [5] LaytonLL.Castorbeanallergyashypersensitivitytothespurges (Euphorbiaceae):absence of reactiontochlorogenicacidinprimaryallergytocastorbean[J].lntArchAllergy,1963,23:225. [6] LaytonLL.Nondiffusibleallergeniccontaminantisolatedfromsamplesofchlorogenicacidcausingallergicreaction:Purechlorogenicacidnotanallergen[J].JAllergy,1966,35(5):268 [7] 孙武勇,刘向辉,屈凌波,等.阿莫西林完全抗原的合成与鉴定[J].郑州大学学报,2007,42(1):72. [8] 蔡碧双,邵幼岩,林纪昀,等.甘草酸人工抗原的合成鉴定及免疫原性分析[J].中国生化药物杂志,2008,29(1):19. [9] 余若祯,何苗,施汉昌,等.2,4D完全抗原的合成及其免疫性能评价[J].环境科学,2006,27(1):146. [10] 杨利国,胡少昶,魏平华,等.酶免疫测定技术[M].南京:南京大学出版社,1998:280.
杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 绿原酸人工抗原的合成及反应条件的优化
绿原酸人工抗原的合成及反应条件的优化