| 杜仲愈伤组织与悬浮细胞中黄酮和绿原酸积累研究 |
| 发布时间:2011-04-18 信息来源:admin 发布人:admin 点击次数:2685 |
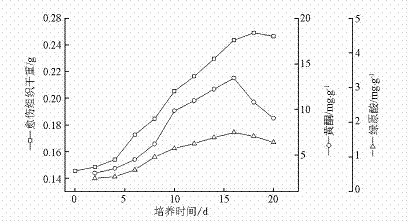
张志斌1,颜日明1,邱晓芳1,曾庆桂1,游海1,朱笃1,2 (1江西师范大学生命科学学院江西省亚热带植物资源保护与利用重点实验室,江西南昌330022; 2江西省天然药物活性成分研究重点实验室,江西宜昌336000) 摘要 比较杜仲愈伤组织和悬浮细胞生长及其次生代谢产物黄酮和绿原酸的积累。将杜仲无菌苗真叶诱导的愈伤组织进行悬浮培养,研究了悬浮培养物生长的动态和总黄酮类及绿原酸产量积累的动态。杜仲愈伤组织中黄酮和绿原酸最高分别达到13.46,1.712mg·g-1,而悬浮细胞中黄酮和绿原酸最高分别达到16.63,3.93mg·g-1。与愈伤组织相比,悬浮细胞具有生长周期短、速率快、黄酮和绿原酸积累量高的优势。 关键词 杜仲;愈伤组织;悬浮细胞;黄酮;绿原酸 杜仲EucommiaulmoidesOliv.为杜仲科杜仲属植物,目前从其皮和叶中分离并鉴定的活性药用成分包括绿原酸、黄酮类、桃叶珊瑚苷等30余种。其中绿原酸具有降压、抗菌、抗病毒等作用,而黄酮类化合物具有预防骨质疏松,降血脂血糖等药用功 效[1]。 近几年来,通过剥皮、采叶来提取药用成分是目前生产杜仲产品的主要手段。由于剥皮和采摘叶片对杜仲的生长具有很大影响,加之自然环境的破坏,使杜仲野生植物资源日趋贫乏。因此,为了更有效的保护杜仲种质资源,研究利用细胞培养方法进行杜仲次生代谢产物的工业化生产势在必行。迄今,杜仲组织快繁以及培养条件对其次生代谢产物合成影响的研究在国内外已有较多的文献报道[26]。但有关杜仲悬浮培养生产次生代谢产物的研究不多,如WangJL等[7]进行杜仲悬浮培养产绿原酸的研究,但培养悬浮细胞最终质量浓度仅达1g·L-1。王亚琴等[8]不同理化因子对悬浮细胞生长及桃叶珊瑚苷的产生进行了研究。本实验研究了愈伤组织和悬浮细胞在培养过程中生长和次生代谢产物积累特征,比较了愈伤组织和悬浮细胞中绿原酸和黄酮的积累规律,以期为大规模细胞培养生产杜仲次生代谢产物提供理论和方法依据。 1 材料与方法 1.1 杜仲种子 杜仲种子2006年11月采于庐山,由南昌大学生命科学学院黄兆祥教授鉴定。 1.2 愈伤组织的诱导[9] 杜仲愈伤组织系由杜仲种子萌发的无菌苗真叶诱导,诱导的培养基为10mg·L-12,4D+10mg·L-1NAA+10mg·L-16BA+07%琼脂的MS培养基。诱导的愈伤组织接种于B5+05mg·L-1NAA+10mg·L-16BA+3%蔗糖+07%琼脂的固体培养基培养。愈伤组织8~10d继代1次,经过4~5代的驯化培养得到无性细胞系。 1.3 细胞悬浮培养体系的建立 将生长旺盛、结构疏松、易于分散的愈伤组织转移到液体培养基(B5+05mg·L-1NAA+06mg·L-16BA+3%蔗糖)中,置于摇床中进行悬浮培养。培养1周后,培养液中即有悬浮单细胞或小细胞团出现。继代培养时,加入等量的新鲜培养液,摇匀,稍静置,待大细胞团沉降后分瓶,不需过滤,即可得到不含大细胞团块的培养物。这样通过3~4次继代培养,即可得到只含单细胞或小细胞团的培养物。 1.4 细胞生长的测定 愈伤组织:每隔2d随机抽取3瓶愈伤组织培养物测其质量。从培养容器中取出培养所得愈伤组织,用滤纸吸净其表面水分,称其鲜重,真空冷冻干燥至恒重,称组织干重。实验重复3次,结果取其平均值。 悬浮细胞:每隔2d随机抽取3瓶悬浮培养物测其质量。悬浮培养细胞经尼龙网过滤,蒸馏水洗涤3次,称重即得其鲜重,真空冷冻干燥至恒重,称重即为细胞干重。实验重复3次,结果取其平均值。 1.5 黄酮、绿原酸的提取与测定 1.5.1 提取方法 将干燥至恒重的愈伤组织和悬浮细胞分别准确称取0.2g,用10mL80%甲醇90℃恒温水浴热提5h[10],所得提取液为供测液备用。 1.5.2 黄酮的测定方法 将上述提取液用滤纸初过滤,吸取滤液0.5mL,加2mL甲醇,025mL5%NaNO2,摇匀,放置6 min,再加0.25 mL 10%Al(NO3)3摇匀放置6min后,加2mL4% NaOH摇匀,放置15min后在510nm波长下测定其吸光度[11]。回归方程为Y=0.83443X,R2 =0.9992(Y为质量浓度g·L-1,X为吸光度)。 1.5.3 绿原酸的测定方法[12] 将提取物用0.45μm微孔滤膜再次过滤,以20μL的进样量进样检测。仪器Agilent1100高效液相色谱仪;色谱柱HypersilC18ODS(46mm×250mm,5μm);流动相乙腈水磷酸(12∶87.9∶0.1);流速1mL·min-1;检测器UV327nm。回归方程为Y=0.01426X,R2 =09991(Y为质量浓度mg·L-1,X为峰面积)。 2 结果与分析 2.1 杜仲愈伤组织的生长和次生代谢产物的积累将继代4代以上生长旺盛、质地疏松的愈伤组织接种到固体培养基上。每隔2d测定培养愈伤组织的干重、黄酮及绿原酸的含量(图1)。
图1 杜仲愈伤组织生长及其次生代谢产物积累 杜仲愈伤组织生长大致呈“S”型曲线,0~4d为其延迟期,是细胞生长的适应期,细胞的生物量增长缓慢。第4天以后,逐渐进入对数生长期,对数生长期持续在4~16d,此期间细胞处于旺盛的分裂状态,是生物量积累的主要阶段。到第16天时细胞干重达到0.2436g/瓶,黄酮从3.57mg·g-1增加到13.46mg·g-1,增加3.78倍,而绿原酸从0.436mg·g-1增加1712mg·g-1,增加了将近4倍。培养的第16~20天细胞进入减速生长期,随着培养时间的延长愈伤组织干重增加缓慢,黄酮和绿原酸含量呈逐渐降低趋势。在培养的18d生物量干重达到最大为2.492mg· g-1,而黄酮和绿原酸分别为10.83,1.604mg·g-1。李琰[4]和唐建军[5]等在研 究不同理化因子对杜仲愈伤组织中次生代谢产物积累的影响时,也发现在培养的后期次生代谢产物的含量呈下降趋势。 2.2 杜仲悬浮细胞的生长和次生代谢产物的积累取经过3次继代获得的形态均匀,生长旺盛的杜仲细胞作为种子细胞系接入到悬浮培养基中进行培养,每2d随机抽取3瓶培养物,测定细胞干重及黄酮、绿原酸的产量(图2)。
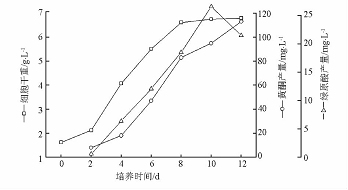
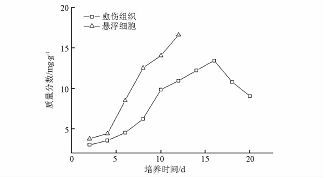
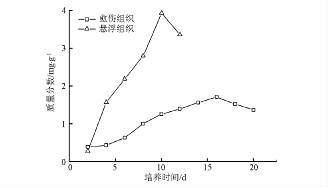
图2 杜仲悬浮培养细胞生长及其次生代谢产物积累 悬浮培养生长曲线和愈伤组织生长曲线类似,细胞生长曲线基本为“S”型,但其滞后期非常短,仅有2d,很快进入了对数生长期。在4~8d时细胞增殖最快,而此时细胞增长速度也最快,达到0.6g·L-1·d-1。到第8天以后,细胞生长速率迅速下降,同时细胞进入生长平稳期,生物量不再增加。在培养前期,黄酮和绿原酸的积累随着细胞生物量的增长而逐渐增加,但2种代谢物的积累状况各不相同,绿原酸产量于培养第10天达到最高值26.57mg·L-1,随后随着培养时间的延长而逐渐减少;而黄酮的积累随着细胞生长而增加,当细胞生长进入停滞期时黄酮的产量仍在增加,呈现典型的部分生长耦联型产物合成特征,这和新疆雪莲细胞悬浮系中黄酮的积累特点相似[1314]。 2.3 杜仲愈伤组织和悬浮细胞的生长和次生代谢产物积累的比较杜仲愈伤组织和悬浮细胞的生长曲线相似,但愈伤组织的生长周期更长,生物量增殖速度更小。与愈伤组织的生长过程相比,悬浮细胞培养具有生长快、周期短、产率高的明显优势。同时作者比较了杜仲愈伤组织和悬浮细胞中黄酮和绿原酸的过程积累量。在相同的培养时间下,悬浮细胞黄酮和绿原酸的含量都要比愈伤组织高(图3,4)。悬浮细胞在生长周期内黄酮和绿原酸积累的最高质量分数分别为16.63,3.93mg·g-1,而愈伤组织最高分别达到13.46,1.712mg·g-1。由此可以看出,和愈伤组织培养相比,悬浮细胞培养对于次生代谢产物的积累具有明显的优势。因此,在野生资源面临枯竭,人工种植无法满足市场对杜仲药源的需求情况下,工业上利用杜仲悬浮细胞培养技术生产次生代谢产物就更具有实际意义。
图3 杜仲愈伤组织和悬浮细胞中黄酮含量的比较
图4 杜仲愈伤组织和悬浮细胞中绿原酸含量的比较 3 讨论 由于细胞与培养环境的相互作用,植物细胞固有的代谢途径和代谢产物与细胞生长的关系就变得更为复杂。一般认为悬浮细胞次生代谢产物的含量要高于愈伤组织,原因可能包括以下2方面:①在液体培养基中细胞的液质接触面大,营养成分可较快渗入细胞内;②在液体培养中抑制细胞生长的代谢产物可较快释放而作为合成次级代谢产物的前体;王俊丽[7,15]等在研究杜仲愈伤组织和悬浮细胞的绿原酸的含量时也发现悬浮细胞绿原酸的含量要高于愈伤组织的含量,当培养条件合适时,悬浮细胞绿原酸的含量可接近杜仲叶的含量。本实验研究发现,杜仲培养过程中悬浮细胞黄酮和绿原酸的积累量也均高于愈伤组织,说明建立悬浮细胞培养系研究细胞生长和次生代谢产物积累规律对于植物细胞培养放大和提高次生代谢产物的得率具有重要意义,也是未来植物细胞培养生产次生代谢产物发展的主要方向。 [1] 唐建军,张禄源,何鸣筱.杜仲的研究与应用进展[J].植物学通报,1998,15(6):47. [2] 黄勇,周吉源.杜仲愈伤组织的诱导及增殖效应[J].华中师范大学学报:自然科学版,2003,37(1):102. [3] 李琰,王冬梅,崔宏安,等.不同因子对杜仲愈伤组织继代培养的研究[J].西北林学院学报,2004,19(1):61. [4] 李琰,董娟鹅,姜在民,等.杜仲愈伤组织中次生代谢产物积累动态研究[J].西北植物学报,2004,24(11):2033. [5] 唐建军,陈欣,志水胜好.培养条件对杜仲愈伤组织形成及次生代谢过程的影响[J].浙江大学学报:工学版,2002,36(2): 193. [6] 李琰,张朝红,马希汉.培养基成分对杜仲愈伤组织生长及次生代谢产物含量的影响[J].武汉植物学研究,2004,22(4): 359. [7] WangJunli,LiaoXiaoru,ChenPiling,etal.AccumulationofchlorogenicacidincellsuspensionculturesofEucommiaulmoides [J].PlantCellTissueOrganCult,2003,74:193. [8] 王亚琴,朱媛.杜仲细胞悬浮培养生产桃叶珊瑚苷的研究[J].广西植物,2007,27(2):236. [9] 邱晓芳,朱笃,张志斌,等.杜仲愈伤组织继代培养基抑制褐化的研究[J].食品科学,2007,28(8):307. [10] KazuhikoM,UsamaIA,YasunoriT,etal.AggregatecharacteristicsofcallusderivedfromwoodyplantEucommiaulmoides[J].BiochemEngJ,2004,21:149. [11] 中国药典.一部[S].2000:177. [12] 中华人民共和国卫生部药典标准[S].北京:人民卫生出版社,2003:126. [13] 刑建民,赵德修,李茂寅,等.水母雪莲悬浮培养细胞生长和黄酮类活性成分合成[J].植物学报,1998,40(9):36. [14] 武利勤,郭顺星,肖培根.新疆雪莲细胞悬浮系的建立和黄酮类活性成分的产生[J].中国中药杂志,2005,30(13):965. [15] 王俊丽,陈丕铃,李会肖.杜仲愈伤组织中绿原酸的含量[J].中国中药杂志,1998,23(6):338. 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 杜仲愈伤组织与悬浮细胞中黄酮和绿原酸积累研究
杜仲愈伤组织与悬浮细胞中黄酮和绿原酸积累研究