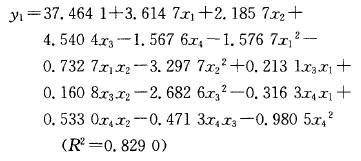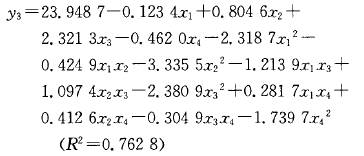| 藤茶黄酮及二氢杨梅素提取条件的优化 |
| 发布时间:2011-03-18 信息来源:admin 发布人:admin 点击次数:3360 |
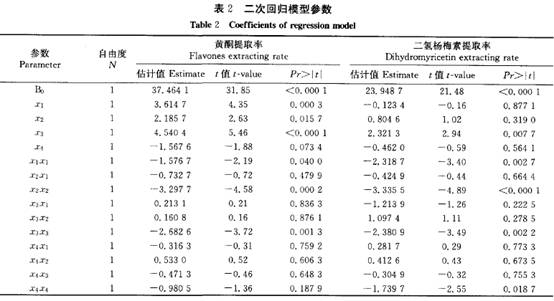
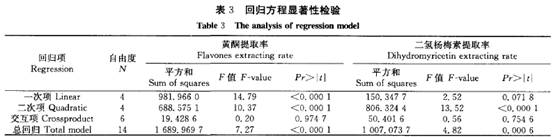
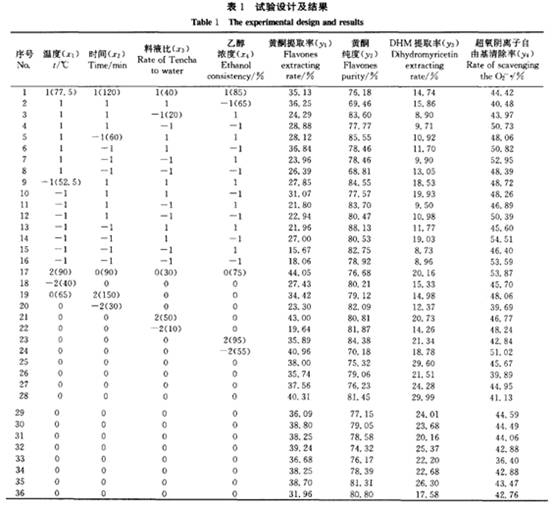
陈玉琼 李安琪 孟 燕 (华中农业大学园艺林学学院/农业部亚热带农业资源与环境重点实验室,武汉430070) 摘要 采用二次回归正交旋转组合设计方法,研究了温度、时间、料液比、乙醇浓度对藤茶黄酮、二氢杨梅素浸提率、粗黄酮纯度及其对超氧阴离子自由基清除率的影响。结果表明:温度、时间和料液比均能极显著影响藤茶黄酮提取率;建立的黄酮及二氢杨梅素回归模型显著性检验达极显著水平,回归模型的预测值与实测值拟合较好。结合粗黄酮的纯度和对超氧阴离子自由基清除率活性分析,藤茶黄酮的最佳浸提条件:乙醇浓度67%~85 ,浸提温度控制在52.5~77.5℃ ,浸提时间6O~100 min,料液比1:31;二氢杨梅素的最佳提取条件:提取温度控制在65℃ ,浸提时间94 min,料液比1:35,乙醇浓度74 。 关键词 藤茶;黄酮;二氢杨梅素;提取 藤茶Ampelopsis grossedentata(Hand-Mazz) w.T.Wang主产于我国,主要分布在湖北、湖南、广东、广西、江西、福建、云南、贵州等地海拔200~1 300 m的山区[1]。藤茶的主要活性成分是以二氢杨梅素为主的黄酮类物质,具有降血脂、消炎和清热解毒功能,是我国特有的一种茶用和药用植物_2 ]。除了将藤茶作为茶用以外,目前已提取藤茶黄酮生产药品和饮料等。 藤茶黄酮的提取工艺主要有水提和醇提2种方法,并以水提法研究较多E7]。王岩等用正交法探讨了乙醇浓度、用量、提取时间和次数对藤茶二氢杨梅素的影响_8]。杨铃用正交设计法,考察了微波提取的温度、辐射时间及料液比3个因素对藤茶中二氢杨梅素得率的影响lg]。成凤桂探讨了以水为提取剂,提取温度、时间和体积对藤茶黄酮提取率的影响 ]。以水为提取剂,虽然提取剂成本低,但提取温度高、时间长,黄酮提取率和纯度低,增加了后续分离纯化的难度,同时在长时间高温作用下,势必降低黄酮活性。 笔者在前期试验的基础上,采用乙醇为提取剂,以清除超氧阴离子自由基活性为跟踪,应用二次回归正交旋转组合设计方法优化藤茶黄酮及二氢杨梅素提取的最佳条件,旨在为工业化生产提供理论依据。 1 材料与方法 1.1 供试材料 供试藤茶来自湖北省恩施风鸣藤茶有限公司。样品粉碎后过孔径0.35 mm筛待用。甲醇:色谱醇,购自Fisher公司;二氢杨梅素:笔者所在实验室自制,纯度达98 ;其它试剂都为国产分析纯。 1.2 试验方法 1)试验设计。黄酮提取条件采用二次回归正交旋转组合设[11] ,试验因子、水平及编码见表1。 2)黄酮提取。工艺流程:藤茶一石油醚回流脱脂1 h一提取一提取液45℃ 条件下真空浓缩至小体积后冷冻干燥得粗黄酮。 3)黄酮含量测定。采用A1C13。比色法[12]。]测定样品中的黄酮含量。 4)二氢杨梅素(DHM)含量测定。采用HPLC法测定样品中的二氢杨梅素(DHM)含量。测定条件:Discovery C18色谱柱,250 mm×4.6 mm,5um。流动相:甲醇/O.1%磷酸(25/75),流速0.8 mI /min,进样量30uL,温度3O℃ ,检测波长292 nm 。 5)超氧阴离子自由基清除率。采用S0D试剂盒(南京建成生物研究所生产)进行清除。试验数据采用SAS统计软件包分析处理。 2 结果与分析 2.1 二次回归模型的组建与检验 供试藤茶各处理黄酮和二氢杨梅素提取率及活性结果见表1。试验结果表明,浸提温度、时间、料(g)液(mL)比对藤茶黄酮的浸提率都有显著影响。通过SAS软件包分析,得到二次回归方程: 经检验,模型的一次项和二次项都达极显著水平,交互作用项不显著(表2)。分析结果表明,各试验因子对黄酮提取率的影响都达显著水平(表3)。回归模型的预测值与实测值能较好地拟合。藤茶中二氢杨梅素提取率的回归方程: 经检验,模型及二次项达极显著水平。一次项及交互项影响不显著。
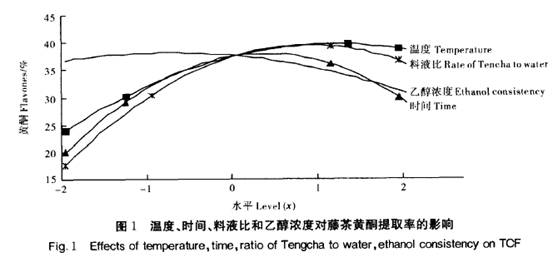
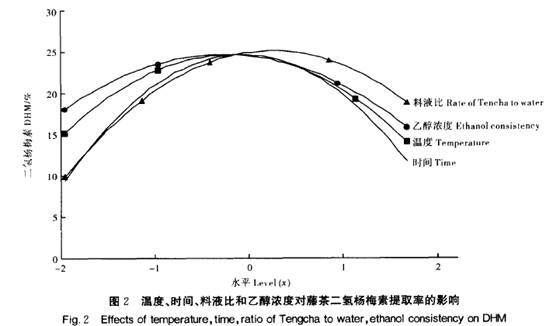
2_2 藤茶黄酮提取工艺的优化 根据回归方程进行降维分析,结果如图1所示。由图1可以看出,浸提温度、时间和料液比对黄酮浸提率的影响较一致,随浸提温度的升高,浸提时间的延长和料液比的增加,黄酮的浸提率呈先增后减的趋势。说明在一定范围内,升高浸提温度、延长浸提时间和增大料液比有利于黄酮的浸出。在浸提温度1.146 3(79.3℃)、浸提时间0.331 4(100 min)、料液比0.846 3(1:31)时,提取率分别达到最大值。而乙醇浓度对黄酮的提取率的影响表现为,乙醇浓度提高时,黄酮的浸出量反而下降,当乙醇浓度为一0.799 4(67 )时,黄酮浸出率最高。 对粗黄酮的纯度分析表明,粗黄酮的纯度与浸提液乙醇浓度呈极显著相关,相关系数0.975 8。说明用高浓度乙醇浸提,其他杂质浸出量减少,有利于黄酮纯度的提高;低浓度的乙醇浸提,黄酮的提取率较高,但其他杂质浸出也增加,不利于黄酮的纯化。对粗黄酮清除超氧阴离子自由基活性分析表明,粗呈显著负相关,相关系数一O.858 7。这可能是在低浓度的乙醇浸提时,其他活性成分浸出较多的缘故。粗黄酮的纯度与浸提温度的相关系数为一0.851 7,与浸提时间的相关系数为一0.718 4,表明随着浸提温度的提高、时间的延长,其他杂质也相应浸提出来,粗黄酮的纯度降低。浸提温度、时间与粗黄酮清除超氧阴离子自由基的活性相关不明显。 综合分析后可得藤茶粗黄酮的最佳浸提条件:乙醇浓度一0.8~1水平,浸提温度控制在1~ 一1水平,浸提时间一1~O.3水平,料液比0.85水平。 2.3 二氢杨梅素提取工艺的优化 对藤茶中二氢杨梅素的降维分析表明(图2),随浸提温度的升高、浸提时间的延长、料液比的增加、乙醇浓度的增大,二氢杨梅素的提取率增加,当各因素增加到零水平附近时达到最大值,即提取温度在一O.026 6(64.67 oC),时间在0.120 6(93.62min),料液比在0.487 8(1:34.88),乙醇浓度在- 0.132 8(73.67 )水平,藤茶中二氢杨梅素的提取率最高。黄酮的提取液浓度与其清除超氧阴离子自由基活性.
3 讨论 藤茶中富含黄酮类物质,其中又以二氢杨梅素含量最多。有关黄酮类化合物的提取方法,主要有水提法和含水乙醇提取法。水提法溶剂成本低,但提出的黄酮往往杂质多,纯化困难,增加后续工序难度。采用含水乙醇浸提,初提物黄酮含量高,故选择乙醇的浓度尤为重要。试验结果表明,如果以黄酮为目标产品,乙醇浓度不宜过高,否则黄酮的得率低,清除超氧阴离子自由基活性不高。高浓度的乙醇浸提,黄酮含量降低,可能是因为降低了其它一些 水溶性较好的黄酮类成分的溶出造成的,有关原因还有待继续探讨。如果以二氢杨梅素为目标产品,应适当提高浸提液乙醇浓度,以提高产品得率及纯度。因二氢杨梅素是一种双氢黄酮醇类化合物,易溶于丙酮、乙醇,水溶性较差[13] 。 黄酮是一类热敏性物质,高温容易引起黄酮的氧化分解,因此在浸提时温度不宜过高。本试验结果表明,藤茶黄酮的提取温度应控制在8O℃ 以下,若超过这个温度,黄酮的提取率反而下降。这可能与其在高温下的氧化降解有关。 由试验结果可知,在一定浸提温度、浸提时间、料液比范围内,随温度的升高、浸提时间的延长、料液比的增加,藤茶黄酮的浸提率提高,当浸提温度超过1.146 3水平、浸提时间超过0.331 4水平、料液比超过0.846 3水平后,黄酮浸提率下降;与黄酮的得率相反,粗黄酮的纯度随浸提温度的提高,浸提时间的延长而下降。料液比与粗黄酮的纯度无显著相关。提高浸提乙醇浓度,黄酮的提取率下降,提取的粗黄酮的纯度提高,清除超氧阴离子自由基活性下降。根据藤茶中二氢杨梅素的提取率分析,其最佳提取条件:提取温度65℃ ,时间93.62 min,料液比1:35,乙醇浓度74 。因此,考虑所提黄酮的纯度及二氢杨梅素的含量,可适当提高浸提液乙醇的浓度,以降低杂质的含量。 参考文献 [1]中国科学院研究所.中国高等植物图鉴补编(第二册)EM].北京:科学出版社,1979:353. [2]陈玉琼,曾维超,盂燕,等.藤茶新工艺加工过程品质化学成分的变化fJ].华中农业大学学报,2008,27(3):441—444. [3]钟正贤,周桂芬,陈学芬,等.藤茶总黄酮药理作用的实验研究EJf1.中国中医药科技,2004,11(4):224—225. [4]何桂霞,杜方麓,杨伟丽.藤茶总黄酮清除氧自由基与抗脂质过氧化作用FJ].中药材,2003,26(5):338—340. [5] 陈玉琼,倪德江,程倩,等.藤茶总黄酮及二氢杨梅素降血脂作用研究I-J].茶叶科学,2007,27(3):221—225. [6] 覃洁萍,钟正贤,周桂芬,等.双氢杨梅树皮素降血糖的实验研究EJ].中国现代应用药学杂志,2001,18(5):351. I-7] 李卫,宁正祥.逆流法提取二氢杨梅索研究I-J].食品科学,2004,25(11):192—194. [8] 王岩,王婴,周莉玲.正交实验法优选藤茶的提取工艺[J].中国中药杂志,2002(4):302~303. [9] 杨玲,郑成,宁正祥.正交实验设计优选二氢杨梅素的提取工艺_J].食品工业科技,2005,26(5):95—97. [1O]成凤桂,欧知义.鄂西藤茶中总黄酮的提取及含量测定[J].中南民族大学学报(自然科学版),2005,24(2):19—22. [11]余加林.农业多元试验统计[M].北京:北京农业大学出版社,1993. [12]熊浩平,杨伟丽,何国庆,等.分光光度法测定显齿蛇葡萄总黄酮含量[J].食品科学,2004(2):144—145. [13]周天达,周雪仙.藤茶中双氢黄酮醇的分离、结构鉴定及其药理活性[J].中国药学杂志,1996,8(31):458—460. 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 藤茶黄酮及二氢杨梅素提取条件的优化
藤茶黄酮及二氢杨梅素提取条件的优化