| 制备型高效液相色谱法分离纯化绿原酸 |
| 发布时间:2011-01-26 信息来源:admin 发布人:admin 点击次数:3549 |
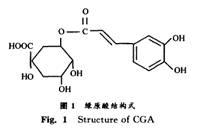
彭密军1,2,周春山1,钟世安1,刘 斌1 (1.中南大学化学化工学院,湖南长沙,410083; 2.吉首大学湖南省林产化工重点实验室,湖南张家界,427000) 摘要:采用制备高效液相色谱技术,从杜仲叶提取物中分离纯化得到高纯活性成分绿原酸。对制备色谱的洗脱方式、洗脱剂组成、浓度、洗脱速度等参数进行优化,提出并应用了流动相速度梯度洗脱方法。最佳操作条件为:采用流速梯度进行洗脱,流速先为28 mL/min,然后为45 mL/min;流动相为15 的有机酸B和0.1 的有机酸E(体积分数);测定波长为254 nm;进样体积为10 mL;进样量为2 500 mg。通过该工艺分离纯化,制备回收率为83.3%,相对标准偏差为3.1%,绿原酸的纯度达98.61%,同时可得到杜仲叶黄酮、桃叶珊瑚甙等副产品。 关键词:绿原酸;高效液相制备色谱;纯化;流速梯度洗脱 杜仲(Eucommia ulmoides Oliv)是我国特有的木本植物,是一种名贵的中药材[1] 。传统上以杜仲皮入药,但近年来的研究结果表明,杜仲叶和皮成分基本相同,特别是杜仲叶中绿原酸和黄酮的含量远高于皮中的含量[2-3]。绿原酸(chlorogenic acid,CGA)学名为3-O-咖啡酰奎宁酸(3-O-caffoylquin—ic),具有抗菌、抗病毒、利胆、增高白血球及兴奋中枢神经系统、抗氧化、抑制高血压等功效[4-9]。国外多以咖啡豆和金银花为原料提取绿原酸,但金银花的用药部位仅限于花蕾[10]。,价格昂贵,资源有限。实验结果表明,杜仲叶片中绿原酸的含量与金银花的相当,而且资源丰富,价格低廉[11]。目前,国内外对杜仲中绿原酸高纯单体的分离研究基本上还处于实验室研究阶段,多采用硅胶或大孔吸附树脂反复柱层析或多级萃取,再采用重结晶法得到少量纯品[12],未见有大型的制备高纯产品的研究报道。在此,作者采用新型制备高效液相色谱对杜仲叶中的绿原酸进行分离纯化,同时从杜仲样品中分离纯化黄酮类化合物(FL)及桃叶珊瑚甙(AU)等产品。 1 实验 1.1 仪器与试剂 1.1.1 仪 器 实验仪器为:HGS型制备液相色谱仪(自组);改性C 8填料(日本Fuji生产,粒径20~ 40 I|m);HGS型紫外检测仪;六通进样阀;TL一Ⅲ型流量调节仪;MN型记录仪。Biotronik液相色谱分析仪(德国制造);BT8200 UV 检测器;BT8100高压泵;Dynamic混合器;C-R6A数据处理仪(日本岛津制造);冷冻干燥机(上海制造);旋转蒸发仪(上海申生制造);Explorer电子天平(瑞士制造);756 MC-Vis分光光度计(上海制造);KQ-lOOE超声波发生器(上海制造)。 1.1.2 试 剂 实验试剂为:甲醇,分析纯,有机酸A,B,C和D,分析纯;有机酸E,分析纯(试剂配制后用o.45m微孔滤膜过滤);绿原酸标准样品(≥98.0 ,购自中国药品生物制品检定所,其结构如图1所示);绿原酸粗品(由杜仲叶水提醇沉,再经大孔吸附树脂纯化后得到);水(为二次蒸馏水)。
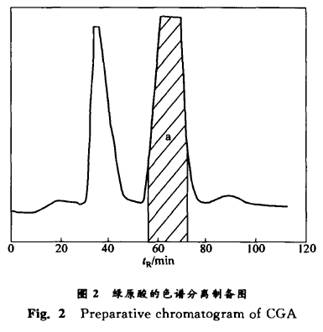
1.2 色谱条件 1.2.1 制备色谱条件 ODS色谱柱(国产不锈钢柱,直径×长为80 mm×500 mm,ClB粒径为2O~40 m);流动相为醇水一酸(体积比为15:85:0.1);流速梯度洗脱;检测波长为254 nm;进样量为10 mL。 1.2.2 分析色谱条件 色谱条件为口引:YWG—C 8色谱柱(直径× 长为6 mm×150 mm,Cl8粒径为5 m);流动相为乙腈一水一乙酸(体积比为10:88:2);流速为1 mL/min,柱温为25℃ ;衰减为3;纸速为3 mm/min;测定波长为326 nm;进样体积为6 L。 1.3 绿原酸的色谱制备 称取适量杜仲叶提取物,加入制备色谱流动相,于超声波中溶解15 rain,配制成 定浓度的制备样品溶液。 制备条件如下:以15 %(体积分数)的有机酸B为流动相,加入0.1%的有机酸E,采用先为28 mL/min,后为45 mL/min的流速梯度进行洗脱,对CGA进行色谱分离制备。根据紫外检测器的实时监测及显色反应的结果[14-15],收集各组分。在该条件下所得制备色谱图如图2所示。可见,其分离效果良好(分离度R≥1.25)。当进样量为2 500 mg时,测定不同切割位置对所得组分中CGA含量的影响。在CGA峰两侧做切线,两切线与基线相交得一区间a,在此区间(57~71 min)接取CGA组分,平行制备5次,CGA的回收率为83.8%,相对标准偏差为3.1%。在18~22 rain接取的为AU 组分,而在28~45min接取的为FL组分。
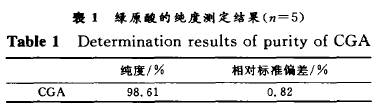
1.4 组分纯度测定 将所收集的相应组分置于旋转蒸发仪中减压回收溶剂,将所得浓缩液置于真空冷冻干燥机中干燥,得到白色晶体。分别称取5 mg产品,用少量分析色谱流动相溶解,并定容到25 mL。用0.45 m 微孔滤膜过滤,按照分析色谱条件进样,采用外标法测定CGA产品的纯度 [13],结果见表1。
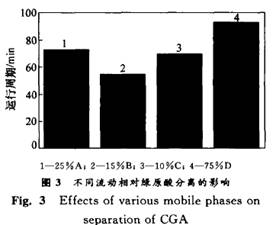
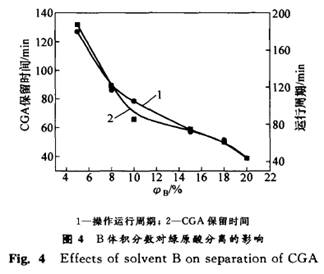
由表1可见,得到的绿原酸产品纯度很高,完全可用作生化试剂标准品,满足新药研发的需要。 2 结果与讨论 在杜仲叶提取分离绿原酸的工艺中,主要干扰物为杜仲黄酮和桃叶珊瑚甙。由于黄酮和绿原酸都属于多酚类物质,其结构和性质十分相近,采用一般经典的溶剂萃取、柱层析均不能获得高纯度的绿原酸。在此,从以下几个方面对制备工艺进行研究。 2.1 流动相组成对分离度的影响 实验考察了用不同低级醇作流动相组分时对分离效果的影响。在保证CGA 与FL充分分离的条件下(R≥0.75),考察用不同体积分数的有机酸A,B,C和D在流速相近、添加剂量相同时对绿原酸的洗脱情况,结果如图3所示。可见,25 的A,15 的B,1O 的C,7.5%的D的分离效果较好,其中15 的B分离效果最好。从图3可以看出,有机酸C和D的洗脱能力较强,要达到较好的分离效果,其含量要低,但操作周期长;若提高其在流动相中的比例,则它们易将色素一并洗下,达不到较好的分离效果,并且这2种溶剂较难回收。在使用有机酸A作流动相时,可以达到很好的分离效果(R≥1.5),但运行周期过长,且有机溶剂消耗量大,不适宜用于大规模生产。当使用有机酸B并加入适当添加剂时分离效果好,且GPA与FL和AU 完全分离。故选择B-水体系为分离制备绿原酸的流动相,并加人适量的有机酸。 2.2 流动相体积分数的优化 在制备色谱中,流动相的体积分数对分离效果有明显影响。当不加入有机酸,用不同体积分数的有机酸B进行等度洗脱时,发现低体积分数的有机酸B对CGA 的洗脱能力不强,耗时太长,消耗流动相多,且分离不完全;而高体积分数的有机酸B洗脱能力较强,当流速较大时,分离效果也不佳,不能同时将CGA与AU,特别是CGA 与FL分开。经综合考虑,确定15%的有机酸B为流动相(如图4所示)。
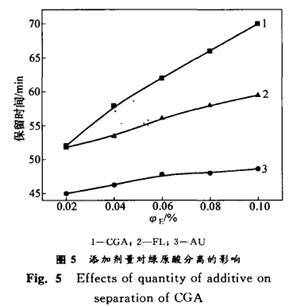
2.3 流动相中有机酸的作用及用量 实验结果表明,在制备色谱上AU 比CGA先出峰,但分离不完全,CGA 与FL的色谱峰也重叠严重。从分子结构上分析,CGA分子中含有1个羧基(如图1所示),而AU 与黄酮则无羧基。要在C,s柱上有效地分离绿原酸、黄酮与桃叶珊瑚甙,必须在调节流动相中有机酸B的体积分数的同时向流动相中加入有机酸E。有机酸E的加入可抑制绿原酸的离解,延长其保留时间,使得各成分彻底分离。本实验考察了向流动相(15%的有机酸B)加入不同体积分数有机酸E对分离效果的影响,结果如图5所示。 结果表明,有机酸E的少量加入可以改善分离度和防止峰的拖尾,延长CGA 的出峰时间,从而使CGA与AU,FL与CGA完全分离(R≥1.25),有机酸E的较适宜体积分数为0.10%。此外,酸性体系可以防止绿原酸在中性或碱性条件下氧化,但对保持柱的稳定性和延长柱的寿命有一定的影响。
2.4 流速及洗脱方式的确定 流速及洗脱方式对分离情况有较大的影响。实验结果表明,当采用低流速时,冲出AU 和FL后还要经很长的时间才能洗脱出CGA。而采用高流速,虽然CGA可以很快洗脱出来,但CGA 与FL的分离效果不佳(R≤0.6),影响产品的质量。 为此,同时对等度洗脱、浓度线性梯度洗脱、流速梯度洗脱等方式进行研究。鉴于本研究的原料是初步纯化过的绿原酸粗品,提出了速度梯度洗脱方法,即用单一配比的流动相,先用低流速将AU 和FL及附近的杂质分开,待洗脱出这些化合物后,立刻将流速调高以快速洗下CGA 组分。实验结果表明,采用该方法,能使CGA与FL及AU 较好地分离(R≥1.25)。为缩短分离时间,且保持较高的分辨率,选择先用28 mL/min,后提高至45 mL/min的流速梯度进行洗脱。 2.5 进样体积对色谱分辨率的影响 进样量为2 500 mg时,研究了进样体积对色谱分辨率和绿原酸中各馏分纯度的影响。结果表明:a.随着进样体积增大,色谱分辨率逐渐降低,色谱峰发生扩散;当进样体积大于12 mL后,色谱分辨率急剧下降,且出现严重的不对称峰形。b.进样体积越大,制备样品中CGA纯度越低。 因此,要分离制备高纯度的绿原酸产品,进样体积不宜太大,选择进样体积为10 mL。 2.6 进样量对色谱分辨率的影响 在进样体积相同的条件下,考察了进样量对色谱分辨率的影响。结果表明:随着进样量的增大,色谱峰变宽,组分峰重叠加重,容量因子K 逐渐减小,分辨率降低,且进样量越大,制备样品中CGA的纯度越低;当进样量大于2 600 mg后,出现峰形不对称,峰前陡峭而峰后拖尾的现象,表明进样量已超过等温吸附的线性范围,选择最佳进样量为2 500 mg。 2.7 讨 论 绿原酸(CGA)和杜仲黄酮(FL)都是杜仲叶中含量较高的活性成分,它们结构和性质相近,用一般柱色谱难以分离完全。此外,杜仲叶提取物中还含有桃叶珊瑚甙(AU)。为保证得到较好的分离结果,必须对不同实验条件下收集的组分进行分析检测,并随时优化实验条件。检测主要采用HPLC法和显色法相结合的方法。显色法包括黄酮一铝盐显色法[1 和桃叶珊瑚甙的艾氏试剂显色法ll51。黄酮和绿原酸都能与铝盐作用,前者在碱性条件下呈黄色,而后者则呈紫红色,有明显的颜色差异。桃叶珊瑚甙的显色反应具有较高的选择性,对桃叶珊瑚甙显蓝色,而与杜仲中的其他2种主要的环烯醚萜类化合物京尼平甙酸、京尼平甙不发生显色反应,与CGA和FL也不发生颜色反应。因此,在实验过程中,采用这2种简单易行的方法进行跟踪检测,效果良好。 3 结论 a.采用反相高效液相制备系统,以乙醇一水和少量羧酸为流动相,制备了CGA。对分离中的主要干扰成分桃叶珊瑚甙和黄酮采用灵敏的显色法进行跟踪检测,并结合高效液相色谱分析法,可得到纯度为98.61 的CGA产品。 b.提出了速度梯度洗脱方法,分离度较高(R≥1.25),同时节省了时间,降低了试剂的用量。 参考文献: [1] Deyama T,Nishibe S,Nakazawa Y.Constituents and pharma—eological effects of Eucommia and Siberian ginseng EJ7.Actapharmacol Sin,2001,22(12):1 057—1 070. [2] 张康健,王蓝,张风云,等.杜仲叶与皮有效成分含量的比较研究[J].西北林学院学报,1996,11(2):42—46. ZHANG Kang-jian,WANG Lan,ZHANG Feng-yun,eta1.Acom paration between active component contents in the bark and leaves of Eucommia ulmoides[J].Journal of Northwest For—estry College,1996,11(2):42—46. [3] 于学玲,朱荣誉,刘晓明.杜仲皮和叶营养成分分析[J].中草药,1992,23(3)l161—163. YU Xue-lin,ZH U Rong-yu。LIU Xiao-m ing. The analysis of nutritional compounds in the bark and leaf of Eucom mia ul—moides[J].Chinese TraditiOnal and Herbal Drugs, 1992,23(3):161—163. [4] Kawasaki T,Uezono K,Nakazawa Y.Ant.hypertensive mech—anism of food for specified health use:Eucommia leaf glycoside and its clinical application[J].J Health Sci,2000,(22):29—36. [5] Uezono K,Kawasaki T,Amamoto T,et a1.Effect of the Eu—commia leaf extract in blood pressure[刀.Therap Res,1997,18:94—97. [6] Metori K,Tanimoto S,Takahashi S.Promotive effect of Eu—commia leaf extract on collagen synthesis in rats[刀.Nat Med,1998,52l465—469. [7] 赵晖.杜仲叶药理作用研究(II)——抗衰老作用[J].国外医学中医中药分册,2000,22(3):151—153. ZHA()Hui.Study on the pharmacological effects of Eucommia ulmoides leaves(II)- antiaging function[J]. Abroad Medi—cine-the Fascicule of Chinese Medicine and Chinese Herbal Medicine,2000,22(3):151—153. [8] Nakamura T,Nakazawa Y,Onizuka Shi,et a1.Antimutage—nicity of Tochu tea(an aqueous extract of Eucommia ulmoides leaves):1. The clastogen-suppressing effects of Tuchu tea in CHO cells and mice[刀.Mutation Research/Genetic Toxicolo—gY and Environmental M utagenesis, 1997,388l7—20. [9] 阴健,郭力弓.中药现代研究及f临床应用l-M].北京:学苑出版社,1993. YIN Jian,GUO Li-gong. Modern research and clinic applica—tion of Chinese traditional medicine l-M].Beijingl Xueyuan PTess,1993. [10] uu Ji ia,ZHAO Guo-ling,WANG Hui,et a1.Extraction process of chlorogenic acid in flos lonicerae by enzymatic treatmentEJ].Journal of Central South University of Technology (English Edition),2002,9(4):246—249. [11] LI Yu-ping,CHEN Xiao-qing,PENG Mi-jun,eta1.Simuha—neous determ ination of geniposidic acid, chlorogenic acid and geniposide in Eucommia by HPLC[J].Journal of Central So uth University of Technology (English Edition), 2003,10(3):198—2O1. [12] 马希汉,张康健,尉芹,等.从杜仲中提取绿原酸纯品的研究[J].西北林学院学报,1996,11(2):58—6o. MA Xi-han,ZHANG Kang-jian,WEI Qin,et a1.A study on the isolation of chlorogenic acid from the leaves of Eucommia ulmoides[J].Journal of Northwest Forestry College,1996,11(2):58—6O. [13] 彭密军.杜仲叶中绿原酸的提取分离及含量测定[J].林业科技,1999,24(6):41—42. PENG Mi-jun.Extracting and separating of chlorogenic acid in Eucommia ulmoides Oliv leaf and its content determ ination[J].Forestry Science& Technology,1999,24(6):41—42. [14] 汤诗杰,盛宁,陆长根,等.不同地理种源杜仲叶片中绿原酸和总黄酮的含量[J].植物资源与环境,1999,8(10):59—61. TANG Shi—jie,SHEN Ning,LU Chang-gen,et a1.The con—tents of chlorogenic acid and total flavonoids of Eucommia ul—moides Oliv leaves among provenances[J].Journal of Plant Resources and Enviroment,1999,8(10):59—61. [15] 邓勇,彭 明.杜仲有效成分的提取[J].农业工程学报,1997,13(3):230—234. DENG Yong, PENG M ing. Extraction of useful ingredients from ulmoides Olives leaves[J].Transaction of the CSAE,1997,13(3):230—234. 产品链接: 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 制备型高效液相色谱法分离纯化绿原酸
制备型高效液相色谱法分离纯化绿原酸