| HPLC 测定川菊中绿原酸的含量 |
| 发布时间:2010-11-10 信息来源:admin 发布人:admin 点击次数:3247 |
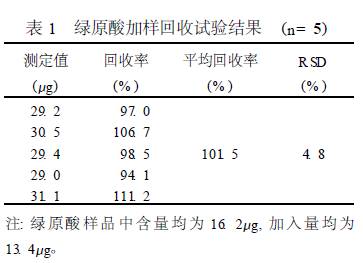
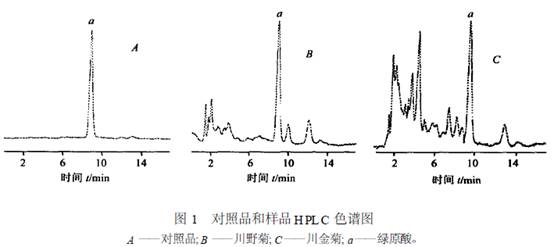
杨振萍 刘思曼a 边清泉①a (西南科技大学理学院 四川省绵阳市 621000) a (绵阳师范学院化学系 四川省绵阳市仙人路一段30 号 621000) 摘 要 建立川菊中绿原酸含量的检测方法。采用高效液相色谱法, 以绿原酸为指标, D iamonsilTM C18 柱(4. 6mm ×150mm , 5um) ; 0. 1mo l·L - 1的N aH2PO 4-CH3OH (7. 3∶2. 7) 为流动相, 检测波长为326nm。平均回收率为101. 5% ,RSD= 4. 8%。进样量在0. 092—0. 552ug, 线性关系良好, r= 0. 9989。该方法简便、稳定、重现性好, 为菊花质量的控制提供参考。 关键词 高效液相色谱, 川菊, 绿原酸。 1 引言 菊花为常用中药, 是菊科植物菊(Chrysan the mum morif olium Ram at. ) 的干燥头状花序, 含有挥发油、黄酮类、绿原酸等多种有效成分[ 1 ]。味甘苦, 性凉; 具有散风清热, 平肝明目的功效, 主要用于风热感冒, 头痛眩晕, 目赤肿痛等症[ 2 ]。绿原酸、异绿原酸是菊花有效活性成分之一, 现代药理研究认为, 绿原酸具有抗菌、抗病毒、抗氧化、抗诱变、抗血小板凝固、保肝利胆等多种保健和药理作用[ 3—5 ] , 是具有较高药用价值的活性成分, 绿原酸含量是衡量川菊药用价值重要指标。目前对植物中绿原酸的定量分析已有大量报道, 关于菊花中绿原酸含量的测定也有报道[ 6, 7 ]。但是, 关于川野菊、川金菊中绿原酸含量的HPLC 法测定尚未见报道, 因此, 本实验建立川野菊、川金菊中绿原酸含量的检测方法, 以供菊花为原料的制药企业选择原料和质量检测时参考。 2 实验部分 2. 1 仪器与材料 LC26AD 型高效液相色谱仪(日本岛津公司) , 包括SPD210AU P 检测器, CLA SS2vp 5. 0 色谱数据处理工作站, CTD26A 色谱柱温箱; 绿原酸对照品(供含量测定用, 批号: 086129902, 中国药品生物制品的检定所) ; 川野菊、川金菊购于绵阳天诚大药房, 经绵阳师范学院分子生物学与生物制药重点实验室刘家琴博士鉴定为菊科植物菊的干燥头状花序; 甲醇、乙腈为色谱纯, 其他试剂均为AR 级; 实验用水为二次重蒸馏水。 2. 2 色谱条件 色谱柱为D iamon silTMC18 (4. 6mm ×150mm , 5um ) ; 0. 1mo l·L - 1 N aH2PO 4-CH3OH (7. 3∶2. 7) 为流动相; 检测波长为: 326nm; 柱温: 32℃; 进样量: 10uL; 理论塔板数按绿原酸峰计算大于4500。 2. 3 样品的处理 样品经干燥、粉碎后过50 目筛, 准确称取川野菊0. 5g, 加入30mL 90% 的丙酮超声提取 30m in, 过滤, 滤渣用8mL 90% 的丙酮超声洗涤2 次, 合并滤液, 定容至50mL , 0. 45um 的微孔滤膜过滤, 取续滤液待测。样品溶液的浓度为10. 0m g·mL - 1。同法制备川金菊样品溶液。 3 结果与讨论 3. 1 校准曲线的制作 对照品溶液的制备, 准确称取绿原酸对照品4. 6m g, 置于100mL 容量瓶中, 加水定容至刻度,得到46ug·mL - 1对照品溶液。待测。取绿原酸的对照品溶液(46Lg·mL - 1) , 分别进样2、4、6、8、10、12LL , 按2. 2 项下测定绿原酸的峰面积, 以对照品进样量x (Lg) 对峰面积均值y 进行线性回归, 得到直线方程y = 31968. 5x -17398. 9, r= 9989。线性范围0. 092—0. 552Lg。 3. 2 精密度试验 分别取绿原酸对照品溶液10LL , 按2. 2 项下连续进样5 次, 结果绿原酸的峰面积分别为741388、743694、744881、741438、743354, RSD= 2. 0% (n= 3)。 3. 3 供试品溶液稳定性试验 取供试品溶液, 每隔2h 进样1 次, 连续进样5 次, 测定绿原酸的峰面积, RSD = 1. 4% , 结果表明, 供试品溶液在8h 内基本稳定。 3. 4 重现性试验 准确称取川野菊样品粉末5 份, 各0. 5g, 按2. 3 项制备供试品溶液, 分别重复测定3 次, 结果绿原酸含量均值分别为5. 9、6. 0、6. 2、5. 8、5. 8m g·g- 1, RSD 为2. 8% (n= 5)。 3. 5 回收率试验 取川野菊样品溶液5 份, 分别加入适当量的绿原酸的对照品, 计算回收率, 结果见表1。 3. 6 样品的测定 在2. 2 项色谱条件下对2 种供试品和对照品溶液行色谱, 见图1。按外标一点法计算各样品中绿原酸的含量, 结果川野菊、川金菊中绿原酸含量分别为6. 0、4. 6m g·g- 1, RSD 分别为1. 6%、2. 7% (n= 3)。
3. 7 检测波长的确定 用DAD 检测器在本实验溶剂体系条件下, 分析了绿原酸对照品色谱峰和2 种样品中目标组分相应色谱峰的紫外光谱, 结果二者的紫外光谱基本一致, 绿原酸326nm 有最大吸收。该处待测组分与杂质峰基本能使基线分离, 检测灵敏度高, 确定检测波长为326nm。 3. 8 流动相体系的选择 文献[6—8 ]流动相分别为CH3CN ∶0. 4% H3PO4 (25∶75) ; 0. 1mo l·L - 1 NaH2PO4∶CH3OH ( 7∶3) ; 0. 1mo l·L - 1磷盐缓冲溶液(pH = 2. 65) ∶CH3OH (76∶24) 等流动相体系, 本实验考察对比后认为采用0. 1mo l·L - 1 N aH2PO 4∶CH3OH (7. 3∶2. 7) 体系能使绿原酸与其他组分有效分离(R> 1. 5) , 保留值适宜, 柱后处理简便。 3. 9 目标组分萃取程度的确定 经过对2 种川野菊、川金菊样品萃取目标组分后的药渣HPLC 检测, 无待测组分特征峰出现,说明样品经丙酮超声萃取3 次后, 绿原酸已萃取完全。 4 结论 川野菊、川金菊样品中绿原酸含量测定结果说明, 两者的有效成分绿原酸含量均较高, 该品种可供绿原酸为活性成分的制剂业作为原料选择。其它活性成分的测定有待进一步研究。
参考文献 [ 1 ] 黄泰康. 常用中药成分与药理手册[M ]. 北京: 中国医药科技出版社, 1994. 1565. [ 2 ] 国家药典委员会编. 中华人民共和国药典(一部) [M ]. 北京: 化学工业出版社, 2000. 254. [ 3 ] Ito H,M iyazak i T,Ono M et al. A ntiallergic A ctivities of Rabdo siin and Its Related Compounds: Chem ical and Biochem ical E2 valuations[J ]. B ioorg. M ed. Chem. , 1998, 6 (7) : 1051. [4 ] J iang Y, Kusama K, Satoh K et al. Induction of Cyto toxicity by Ch lo rogenic A cid in Human O ral Tumo rcell L ines [J ]. P hy 2 tom ed icine, 2000, 7 (6) : 483. [ 5 ] 高锦明, 张鞍林, 张康健. 绿原酸分布、提取与生物活性研究综述[J ]. 西北林学院学报, 1999, 14 (2) : 73—82. [ 6 ] 桑旭峰, 吴海雯. 徐奇超. HPLC 同时测定银黄口服液中绿原酸和芩苷含量[J ]. 中成药, 2005, 27 (1) : 96—98. [ 7 ] 宁文. 菊花不同炮制品中挥发油和绿原酸含量的测定[J ]. 广亚中医药, 2003, 26 (5) : 56—57. [ 8 ] 李鹏, 陈科力, 叶从进. 湖北福田河白菊质量研究[J ]. 中药材, 2004, 27 (2) : 102—103. 产品链接: 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 HPLC 测定川菊中绿原酸的含量
HPLC 测定川菊中绿原酸的含量