| 大黄素葡甲胺犬静脉注射犬体内药动学研究 |
| 发布时间:2010-11-01 信息来源:admin 发布人:admin 点击次数:6055 |
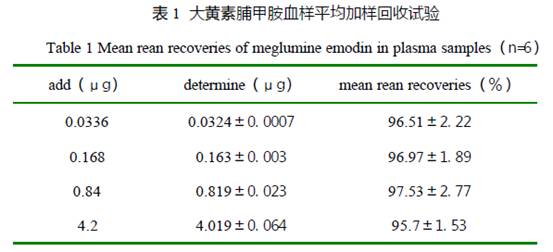
蒋王林 1,2*,高玉白1,田京伟1,傅风华1 (1 山东省天然药物工程技术研究中心烟台大学药学院 山东 烟台 264003; 2 中国药科大学,江苏 南京 210009) 摘要 目的研究大黄素葡甲胺犬静脉注射体内药动学特征。方法 beagle 犬6 只,4mg.kg-1 静脉注射,取血,HPLC 测定血浆药物浓度。结果 大黄素葡甲胺在犬血中符合二房室模型处置特征,T1/2α:5.3±2.9min;T1/2β:37.4±6.7min;k21:0.035±0.009min-1;k10:0.085±0.030min-1;k12:0.069±0.062min-1;VC:347.3±84.4mL.kg-1;AUC:0.147±0.024min.mg.mL-1;CL:27.8±4.5mg.(kg.min)-1。结论 大黄素葡甲胺静脉注射在犬体内半衰期短,具有消除快,无药物蓄积的特点。 关键词 大黄素葡甲胺药动学 HPLC 二房室模型 大黄素具有抗炎作用,能显著抑制乙酸所致的小鼠毛细血管通透性增加[1];促进豚鼠离体肠管收缩[2];呈剂量依赖性加强豚鼠结肠带平滑肌细胞电和收缩活动,机制与抑制细胞膜KATP 等钾通道的活性相关[3];亦明显抑制大鼠肝纤维化形成[4]。我们进行药理研究时发现大黄素 10mg.kg-1 静脉注射给药对大鼠实验性肠粘连有较好的治疗作用(另文发表),为此我们对大黄素静脉注射在犬体内的药动学进行了研究,为临床用药提供理论指导。 1 材料 1.1 药物与试剂:大黄素葡甲胺冻干粉针(由山东省天然药物工程技术研究中心制剂室提供,批号:规格:50mg);肝素钠注射液(徐州万邦生化制药有限公司,批号:020419);大黄素葡甲胺对照品(自制,纯度达99.5%以上);色谱纯甲醇,高氯酸、乙酸乙酯为分析纯,重蒸水(自制) 1.2 动物:种属:beagle 犬,性别和数量:6 只,♀♂各半。动物年龄和体重:4 个月龄,6.5~8.0kg,动物来源:中国科学院上海实验动物中心,动物合格证号:中科沪动管第99-0011 号 1.3 仪器:HPLC 色谱仪(泵:TSP P2000;自动进样器:TSP AS3000;检测器:UV3000;工作站 OS/2 cHemstation;恒温箱);色谱柱:discovery C18 柱(25cm×4.6mm,粒径:5μm);低压溶剂过滤器;冷冻离心机,,涡旋振摇器,电子秤 2 方法 2.1 色谱条件[5]:流动相:甲醇:0.1%磷酸水溶液( 85:15);流速:1.0mL.min-1;检测波长:254nm;柱温:40℃ ;采用标准曲线法定量测定血浆大黄素葡甲胺浓度。 2.2 样品处理方法:犬股静脉抽取2.0mL 血,肝素抗凝,3000r*min-1 离心10min,取血浆0.40mL 于1.5mL eppendorf 管中,加入6%高氯酸0.20mL,闭塞,于振摇器上振摇1 分钟,加入乙酸乙酯0.40mL,闭塞,于振摇器上振摇1 分钟,10000r*min-1 离心10min,精密吸取乙酸乙酯层0.20mL 于1.5mL eppendorf 管中,于40℃ N2 吹干,精密吸取色谱醇甲醇0.60mL,振摇溶解转移至1.5mL 的进样甁中,自动进样,上HPLC,进样体积为20μL,用标准曲线法进行色谱分析。 2.3 试验方案:取大黄素葡甲胺冻干粉针,NS 溶解,配制成4.0 mg/ml 的药液,随即取beagle 犬6 只,耳缘静脉给药,剂量:4.0 mg.kg-1(按对大鼠实验性肠粘连具有治疗作用的有效剂量 10mg.kg-1 制定的),给药体积:1.0 ml/kg,10s 给完,于给药2、10、20、30、40、50、60、75、90、120 分钟后犬大腿静脉抽血2 mL,肝素抗凝,随即离心,3000 r*min-1 10min,取上清液0.40 mL,其余操作同2.2项下。 2.4 标准曲线:取空白犬血浆,使血浆中大黄素脯甲胺标准品的浓度为0.13、0.26、0.65、1.30、3.25、6.5、16.25 μg.mL-1,分别取血浆样品0.40 mL,按2.2 项下操作后进行HPLC 测定,进样体积为20 μL,实际大黄素脯甲胺标准品的进样浓度为0.043、0.086、0.215、0.43、1.075、2.15、5.375 μg.mL-1,得到大黄素葡甲胺的面积( Abb)。以Abb 值作为Y 轴,以血浆大黄素葡甲胺浓度( Cbb)为x 轴,得标准曲线为:y=87708*x+893(r=0.9996),结果表明血浆大黄素葡甲胺浓度0.043μg.mL-1~5.375μg.mL-1 线性关系良好。 2.5 回收率:取含大黄素脯甲胺对照品浓度分别为1.70μg.mL-1、0.85μg.mL-1、0.425μg.mL-1、0.213μg.mL-1 的犬血浆0.40 mL,每一浓度分别取6 个样品于1.5mL eppendorf 管中,加入6%高氯酸0.20mL,闭塞,于振摇器上振摇1 分钟,加入乙酸乙酯0.40mL,闭塞,于振摇器上振摇1 分钟,10000r*min-1 离心10min,精密吸取乙酸乙酯层0.20mL 于1.5mL eppendorf 管中,于40℃ N2 吹干,精密吸取色谱醇甲醇0.60mL,振摇溶解转移至1.5mL 的进样甁中,结果四种浓度梯度的大黄素脯甲胺回收率见表1。
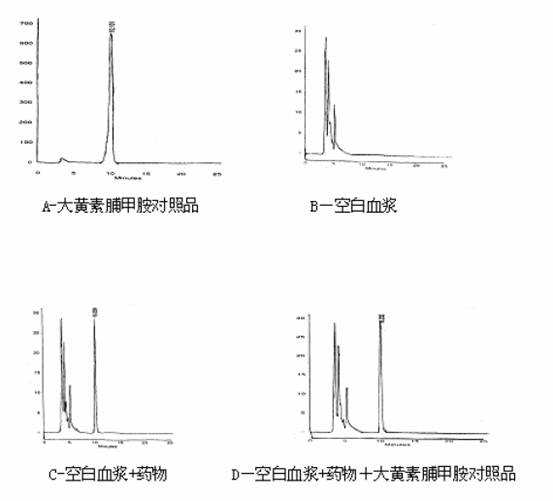
2.6 日内与日间精密度:含大黄素脯甲胺低、中、高浓度血浆0.086、1.075、5.375μg.mL-1,按2.2 项下操作后进行HPLC 测定,在48h 内测定6 组,结果48小时内RSD 值为3.51%,2.45%,1.89% 。 2.7 稳定性:按标准曲线配制方法配制含大黄素脯甲胺浓度为0.26μg.mL-1、3.25μg.mL-1、16.25 μg.mL-1血浆样品,每个浓度5份,每隔5天按2.2项下操作后进行HPLC 测定1份,考察样品在-20℃冷冻放置条件下的稳定性 。结果3种浓度的大黄素脯甲胺血浆样品在2 0天的稳定性较好,RSD 值为4.58%,4.29%,4.35.%。 2.8 检测限:以信噪比(S/N)为3 时的大黄素脯甲胺对照品浓度为本HPLC 方法的检测限,取空白犬血浆,使血浆中大黄素脯甲胺标准品的浓度为0.02μg.mL-1、0.040μg.mL-1、0.080μg.mL-1,分别取 0.40 mL 血浆,按2.2 项下操作。结果本法的检测限达0.013μg.mL-1。 2.9 专一性:由色谱图1 可以看出,犬血浆内源性物质与大黄素脯甲胺能很好地分离,均已达到基线分离效果,含大黄素脯甲胺血浆,处理后加入大黄素脯甲胺对照品溶液,峰重叠,表明专一性良好,成为标准曲线法定量分析犬血浆大黄素脯甲胺浓度的前提。 2.10 数据处理:应用中国药理学会委员会编制的3P97 药动学计算软件进行处理 大黄素脯甲胺血浆药物浓度。 3 结果 3.1 各样品色谱图:见图1。大黄素脯甲胺对照品色谱图显示大黄素脯甲胺对照品的色谱峰均一,定量99.5%,保留时间为10.101min,从犬的空白血浆色谱图可以看出血浆杂质出峰比较靠前,在大黄素脯甲胺保留时间前后,无明显杂质峰,犬含药保留时间为10.228min,犬含药血浆处理样品加入黄素脯甲胺对照品保留时间为10.232min。 3.2 大黄素葡甲胺血药浓度-时间曲线
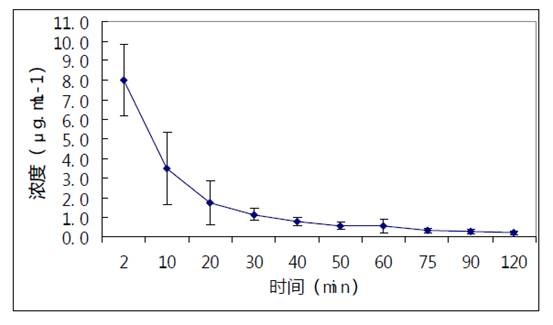
Fig.1 HPLC chromatograms of meglumine emodin reference substance (A) ,blank plasma(B), plasma with drug(C), and plasma with drug added reference substance(D) 6 只犬静脉推注大黄素脯甲胺后,测得大黄素脯甲胺平均血药浓度-时间曲线见图2。
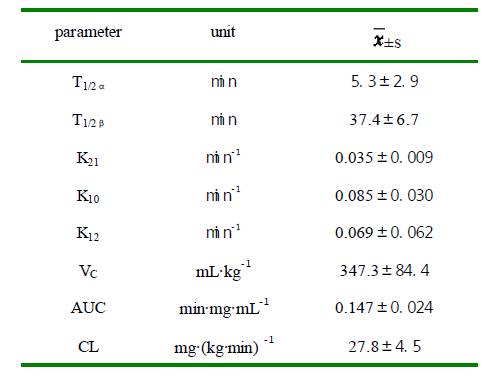
图2 大黄素葡甲胺静脉推注犬血药浓度-时间曲线 Fig.2 The curve of plasma drug concentration and time afte iv meglumine emodin 3.3 大黄素葡甲胺药物动力学特性 大黄素脯甲胺静脉推注在犬体内的药动学过程符合二房室模型,其主要药动学参数见表2。 表 2 大黄素葡甲胺静脉注射犬体内药动学参数 Table 2.The pharmacokinetic parameters in dogs after venous injection meglumine emodin parameter unit
结果表明大黄素脯甲胺在犬体内半衰期短,大黄素脯甲胺静脉推注具有消除快,无药物蓄积的特点。 4 讨论 孙阳等[6]研究了大黄素及其代谢产物在小鼠体内排泄的定量分析,结果小鼠单剂量口服大黄素91 mg/kg,在0-48h 内,使用750 型微量紫外-可见分光光度计测定尿及粪中总蒽醌排泄量为剂量的53%,其中在0-24 小时尿排泄量为剂量的30%。王新宏[7]等对大鼠灌胃给予大黄,结果测定了血浆中大黄五种蒽醌苷元芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量。庞志功[8]等研究了家兔灌胃给予大黄后,测定了家兔体内大黄素、大黄酚,血样前处理使用薄层板分离大黄素、大黄酚进行荧光测定,以上研究均未对大黄素进行药动学研究。J.W.Liang 等[9]对大黄素静脉给药在家兔(n=6)体内的药动学进行了研究,结果静脉给药10mg.kg-1 后在家兔血中符合二房室模型处置特征,AUC:0.518±0.355min.mg·mL-1,CL:72.3±49.2mg·(kg.min) -1,T1/2α:6.85±1.96 min;T1/2β:227±246 min,血浆蛋白结合率高达99.6%。 本文首次对大黄素葡甲胺盐在犬体内药动学进行了研究,结果犬静脉推注4mg/kg 后在犬血中符合二房室模型处置特征,与J.W.Liang 等的研究结果基本相同。 该方法色谱行为、大黄素脯甲胺血样日内与日间差试验、稳定性试验、精密度试验、大黄素脯甲胺血样加样回收试验均符合要求,该方法分析时间短,大黄素出峰时间短,无干扰峰的特点,适用于血样中的大黄素的测定。 References [1] QI Hong.The anti-inflammation of emdoin.Zhong Cao Yao[J](in Chinese),1999,30(7):522-523. [2] JIN Zhuhua,Ma Delu,Lin Xiuzhen,etal.Study on Effect of meglumine meglumine emodin on the Isolated Intestinal Smooth Muscle of Guinea-Pigs. C JI T WM[J](in Chinese),1994,14(7):429-431. [3] LI Junying,Yang Wenxin,Hu Wenweit,etal. Effecth of Meglumine meglumine emodin on the Activity of K Channel in Guinea Pig Taenia Coli Smooth Muscle Cells. Acta Pharmaceutica Sillica[J](in Chinese),1998,33(5):321—325. [4] ZHAN Yutao,Li Dingguo,WEI Hongshan,etal.Effect of meglumine meglumine emodin on Development of Hepatic Fibrosis in Rats. C JI T WM[J](in Chinese),2000,20(4):276-278. [5] CHEN Xin,Cheng Yuying,Hu Yuzhu,etal.Determination of emodin in Niuhuang Jiedu Pian by HPLC and Studies on Method Ruggeddness.Journal of China Pharmaceutical Univeristy[J](in Chinese),1994,25(6):335-338. [6] SUN Yang,Li qiang,Chen Qionghua.Excretion of emodin and its metabolites in mice.Journal of Nanjing College of Pharmacy[J](in Chinese),1986,17(2):132-134. [7] WANG Xinhong,Fan Guangping,An Rui,etal. Determination of the dissociative Rhubarb by HPLC in rats plasma.ZhongChengYao[J](in Chinese),1999,19(1):37-39. [8] PANG Zhigong,Wang Baoqi,Li Shengyou.Studies the pharmkinetics of Emodin and Chrysophanol in rabbits.Journal of Xi,an Medical University[J](in Chinese),1993,14(4):346-348. [9] J W Liang,S L Hsiu,P P Wu,et al.Emodin Pharmacokinetics in Rabbits.Planta Med[J],1995,61:406-408.Pharmacokinetic of meglumine emodin in dogs after venous injection 产品链接: 杜仲提取物 绿原酸 金银花提取物 苦杏仁苷 枇杷叶提取物-熊果酸 大花紫薇提取物-科罗索酸 上禾生物 专注植提 精于高纯 基于您对天然产物需求持续创新 |







 大黄素葡甲胺犬静脉注射犬体内药动学研究
大黄素葡甲胺犬静脉注射犬体内药动学研究